Обоснование сэндвич-методики использования костного материала и описание пилотных случаев
DDS, MDS
Профессор, заведующий кафедрой отделения постдипломного образования стоматологического факультета мичиганского университета (США).
DDS, MS
Профессор, заведующий кафедрой пародонтологии Пенсильванского университета (Филадельфия, Пенсильвания, США).
DDS, MSD, PhD
Профессор, кафедры пародонтологии и челюстно-лицевой хирургии стоматологического факультета Мичиганского университета (Энн Арбор, Мичиган, США).
© Издательство «Индекс Медиа», 2004–2025. Все права защищены. Любое использование материалов или их фрагментов допускается только с письменного разрешения ООО «Индекс Медиа».
При наличии показаний к установке дентальных имплантатов на этапе планирования лечения необходимо учитывать несколько факторов для оптимизации функциональных и эстетических параметров реставрации. Одним из ключевых факторов является объем альвеолярной кости. Неадекватная высота, ширина или качество альвеолярной кости может сделать невозможной идеальную установку имплантата и поставить под сомнение возможность достижения удовлетворительного окончательного клинического результата. Кроме того, контур мягких тканей в значительной степени зависит от имеющихся высоты и ширины гребня. Коррекция костных дефектов позволяет не только правильно установить имплантаты (с точки зрения их положения и размеров), но и позволяет исправить имеющийся дефицит мягких тканей и улучшить эстетику в целом.
Регенерация кости в области костного дефекта представляет собой довольно сложную задачу.1,2 Новая кость образуется благодаря остеогенному потенциалу клеток надкостницы и костного мозга. Кроме того, для успешной регенерации требуется наличие сгустка крови и жизнеспособных остеобластов, а также контакт с живой тканью.3,4 Основной причиной, ограничивающей регенерацию кости, является быстрое заполнение костной раны клетками мягких тканей, поскольку они мигрируют и делятся быстрее клеток, образующих кость.5,6 Из-за врастания мягких тканей остеогенез в пределах костного дефекта нарушается или не происходит вовсе. В литературе описано несколько механизмов костной регенерации: остеоиндукция (вещества, индуцирующие образование кости), остеокондукция (материалы, служащие матрицей для врастания новой кости), дистракционный остеогенез (стимулированный хирургический перелом), пересадка аутогенных костных блоков и направленная костная регенерация кости (НКР) (ограничение мембранами пространства для заполнения его костью).7,8
Концепция НКР была разработана на основании многообещающих результатов использования принципа направленной тканевой регенерации (НТР) для устранения пародонтальных дефектов. Направленной регенерацией кости называют «вмешательства с целью регенерации или наращивания кости для правильной установки стоматологических имплантатов».9 Первые исследования, направленные на изучение методик устранения костных дефектов показали, что объем новообразованной кости при использовании мембраны больше, чем без мембраны.10,11 Эти же исследования доказали, что барьерные мембраны позволяют защитить сгусток крови от проникновения неостеогенных клеток, улучшают стабилизацию раны и обеспечивают (сохраняют) пространство, которое заполняется костной тканью.11,12 Ограниченное мембраной пространство заполняется молодой, активно растущей костью к 90-му дню, в то же время в незащищенных дефектах новой кости не образуется.13,14 Первое описание использования принципов НКР в клинических случаях реабилитации пациентов с помощью имплантатов принадлежит Nyman и соавт.15 С этого момента упомянутая методика стала частью стоматологической имплантологии. Исследования доказали, что использование костной стружки с мембраной дает лучшие результаты, чем использование такого же материала без мембраны, а также что НКР является эффективным методом наращивания кости.15–21 Впрочем, результаты разных исследований могут сильно отличаться, вероятно, из-за использования разных костных материалов.
В данной статье описано поэтапное использование сэндвич-метода для увеличения объема альвеолярного гребня в дентальной имплантологии и приведены результаты первых пяти клинических случаев ее применения.
СЭНДВИЧ-МЕТОД ИСПОЛЬЗОВАНИЯ КОСТНЫХ МАТЕРИАЛОВ
Описание методики
Аутогенная кость считается идеальным материалом для костной подсадки, поскольку быстро образует костную ткань и (или) замещается ею, а также обладает остеогенными, остеоиндуктивными и остеокондуктивными свойствами. Недостатком такой кости является ее доступность. Объем внутриротовых источников ограничен, кроме того, обычно требуется дополнительный разрез, что увеличивает послеоперационный дискомфорт и болезненность. Коммерчески доступные костные материалы (например, аллогенная деминерализованная лиофилизированная кость (АДЛК) или гидроксиапатит (ГА)) лишены такого недостатка. Однако они не обладают остеогенными свойствами и служат лишь матрицей для новообразующейся кости (остеокондукция).
Основным компонентом сэндвич-методики является аутогенная кость, которую укладывают первым слоем на поверхность имплантата. Во время препарирования кости для установки имплантатов можно получить значительный объем костной стружки, просто очищая сверла после каждого использования. Если собранной кости недостаточно для заполнения дефекта до уровня прилежащей кости, то необходимы дополнительные материалы. АДЛК является материалом выбора, поскольку состоит большей частью из коллагена – наиболее важного органического компонента кости. Этот материал также содержит костные морфогенетические протеины, которые способны индуцировать образование кости. Аутогенная кость и АДЛК располагается на поверхности имплантата и альвеолярной кости, что создает идеальные условия для миграции и пролиферации остеогенных клеток и последующего замещения костных материалов костью.
Необходимое пространство для костного материала создается (поддерживается) за счет бычьего ГА, который помещают поверх всех других костных материалов. Для создания адекватного пространства ГА укладывают так, чтобы он выступал (в щечно-язычной плоскости) на 2–3 мм за уровень прилежащей кости. Для предупреждения миграции клеток мягких тканей внутрь костных материалов, часто рекомендуют использовать мембраны. Резорбируемые коллагеновые мембраны более предпочтительны из-за хорошей биосовместимости с тканями полости рта, гемостатических свойств и способности влиять на хемотаксис фибробластов (что ускоряет заживление раны), кроме того, такие мембраны не нужно удалять.
Для успеха описанного подхода необходимо учитывать еще два фактора. Первичная стабильность имплантата должна быть достигнута до введения костного материала, поскольку подвижный имплантат не интегрируется. При подвижности более 100 мкм имплантат чаще всего инкапсулируется фиброзной капсулой.22–27 Механизм такого явления похож на механизм образования ложного сустава при неадекватной иммобилизации костных отломков при лечении перелома. Другим важным фактором являются точная адаптация краев раны и ушивание лоскута без натяжения. Ограничение негативного влияния на рану среды и микрофлоры полости рта способствует успешной регенерации кости.
Показания
Сэндвич-методика показана для наращивания гребня по ширине, а также для устранения окончатых и щелевидных дефектов.28 Данную методику можно использовать для наращивания гребня или при немедленной установке имплантатов.
Противопоказания
Любое противопоказание к обычному пародонтологическому или имплантологическому вмешательству является противопоказанием и к использованию сэндвич-методики. Любой воспалительный процесс в области планируемой пересадки костного материала необходимо купировать до операции.
Хирургические принципы
Основой сэндвич-методики являются три слоя костных материалов, покрытых коллагеновой мембраной для препятствования попаданию клеток мягких тканей в область костной подсадки. Для успешного наращивания кости сэндвич-методом необходимо соблюдать перечисленные ниже хирургические принципы.
Наиболее частым осложнением наращивания кости является рецессия ушитого лоскута.8,29 Начальный разрез следует делать в пределах кератинизированной десны, поскольку она прочнее некератинизированной. Адекватный дизайн лоскута позволяет ушить рану без натяжения.
Очень важно помнить о правильном отслаивании полнослойного лоскута. Если после отслаивания лоскута на поверхности кости остаются остатки надкостницы, их следует тщательно удалить перед нанесением костного материала. Слизистый лоскут можно отслаивать только апикальнее области использования костного материала, чтобы мобилизовать слизисто-надкостничный лоскут и ушить его без натяжения.
Декортикация принимающего ложа может ускорить врастание сосудов в толщу костного материала, что получило название «местного ускорения регенерации».30 Такая процедура может привести к быстрому увеличению популяции остеогенных клеток в области сгустка и ускорить регенерацию кости.
Внутренний слой костного материала при использовании сэндвич-метода состоит из аутогенной кости, которую собирают во время остеотомии и укладывают непосредственно на поверхность имплантата, что ускоряет миграцию жизнеспособных костных клеток в поверхность имплантата.
Если собранной кости недостаточно для заполнения дефекта до уровня прилежащей кости в щечно-язычном направлении, добавляют следующий слой материала. Средний слой сэндвича состоит из АДЛК (Puros, Centerpulse), который может высвобождать костные морфогенетические протеины в рану, инициируя образование кости. Аутогенная кость и АДЛК расположены непосредственно на поверхности имплантата и альвеолярного гребня, что создает идеальные условия для миграции и пролиферации остеогенных клеток и последующего замещения костных материалов новообразованной костью.
Наружный слой образован твердыми частицами ГА, обладающего остеокондуктивными свойствами, он служит матрицей и заполняет пространство. ГА способствует образованию новой кости, удерживая пространство.
После нанесения всех слоев костных материалов их покрывают коллагеновой мембраной, использование которой иммобилизует костный материал и препятствует попаданию в него нежелательных клеток. Коллагеновые мембраны предпочтительны из-за хорошей биосовместимости и естественной резорбции. Кроме того, коллаген является хорошим гемостатическим средством, стимулирует агрегацию тромбоцитов, ускоряет образование фибриновой сети, что может ускорить образование, стабилизацию и созревание сгустка крови.31 Кроме того, коллаген вызывает хемотаксис фибробластов in vitro.32 Это свойство может ускорить миграцию клеток и способствовать первичному закрытию раны, что очень важно при костной подсадке.
Слизисто-надкостничный лоскут затем смещают коронально и ушивают рану без натяжения тканей. Для этого после вертикальных мобилизирующих разрезов надсекают надкостницу и (или) отслаивают апикально слизистый лоскут. При ушивании лоскутов с натяжением рана, скорее всего, заживет вторичным натяжением в ходе контракции.33 Для продолжительного удержания краев раны рекомендуется использовать длительно рассасывающиеся (Vycril, Ethicon / Johnson & Johnson) или нерассасывающиеся (Gore-Tex, WL Gore) материалы.
После операции пациентам рекомендовали полоскать полость рта теплым раствором соли 2 раза в день в течение двух недель, а в течение последующих двух недель – раствором хлоргексидина. Также рекомендуется назначить антибиотики: амоксициллин по 500 мг 3 раза в день, в течение 10 дней, а при аллергии к нему, азитромицин по 500 мг в день, в течение 3 дней.
Швы чаще всего снимают на 10–14, сутки после операции. Пациента осматривают через каждые 4–6 недель для оценки заживления раны. При отсутствии обнажения мембраны дальнейшее заживление происходит без осложнений.3 Вторую операцию (т.е. установку или раскрывание имплантатов) не следует проводить раньше, чем через 5–6 мес.
МАТЕРИАЛЫ И МЕТОДЫ
Пятеро пациентов с щелевидными дефектами в области имплантатов проходили лечение в клинике пародонтологии стоматологического факультета Мичиганского университета. Размер дефектов составлял от 6 до 15 мм (в среднем 10,5 мм). Клинические параметры оценивали во время установки имплантатов и сразу после их раскрывания через 6 мес после установки. Краевую резорбцию кости вокруг имплантатов измеряли с помощью стандартного пародонтологического зонда и округляли до одного миллиметра в сторону ближайшего значения. Кроме того, проводили рентгенографию и делали цветные клинические снимки (в масштабе 1:1). Хирургический этап провели в соответствии с вышеописанными принципами сэндвич-методики. Все имплантаты установили в два этапа.
РЕЗУЛЬТАТЫ
В ходе лечения осложнений выявлено не было. В среднем увеличение кости составило 10,5 мм кости, т.е. дефекты заполнились на 100% (табл. 1).
Таблица 1. Результаты наращивания кости сэндвич-методом для коррекции дефектов в области имплантатов*
| Пациент | Возраст | Пол | Размер дефекта (мм) | Краевая резорбция кости в области имплантата через 6 мес после операции (мм) |
|---|---|---|---|---|
| 1 | 36 | Ж | 13 | 0 |
| 2 | 41 | Ж |
7 9 |
0 |
| 3 | 46 | М | 6 | 0 |
| 4 | 39 | М | 13 | 0 |
| 5 | 28 | Ж | 15 | 0 |
| Среднее | 38 | 10,5 | 0 |
* 100%-ного заполнения дефекта достигли во всех случаях
При зондировании новообразованная кость была твердой и клинически напоминала интактную кость (рис. 1–4).
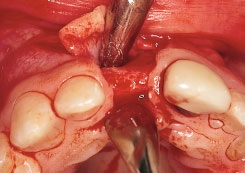
Рис. 1а. Наращивание кости сэндвич-методом у пациента № 1. Откинут полнослойный лоскут, видна неадекватная ширина альвеолярного гребня
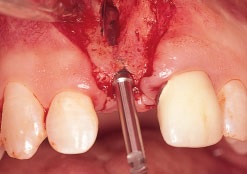
Рис. 1b. После подготовки ложа имплантата виден окончатый дефект с щечной стороны гребня
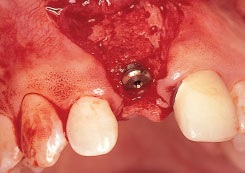
Рис. 1с. Установлен титановый имплантат (3,75 мм × 13 мм; Brånemark, Nobel Biocare), получена первичная стабильность
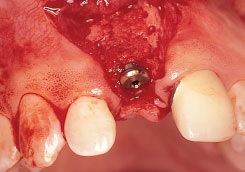
Рис. 1d. Аутогенная кость, собранная во время подготовки ложа имплантата, уложена на его поверхность первым слоем, средний слой состоит из АДЛК
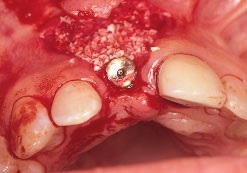
Рис. 1е. Внешний слой образован бычим ГА (Bio-Oss)
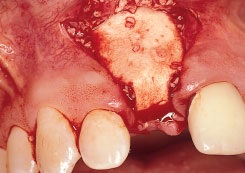
Рис. 1f. Коллагеновая мембрана (Bio-Mend Regular, Zimmer Dental) обрезана и адаптирована к костному дефекту
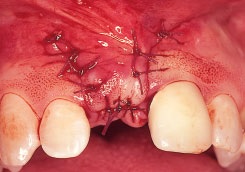
Рис. 1g. Лоскут смещен коронально и ушит викрилом толщиной 5-0
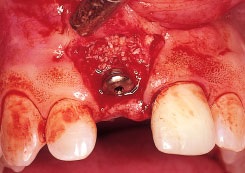
Рис. 1h. Раскрытие имплантата через 6 мес, дефект полностью заполнен костной тканью
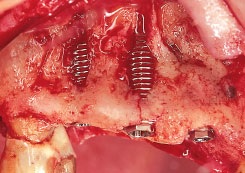
Рис. 2а. Наращивание кости сэндвич-методом у пациента № 2. Откинут лоскут, видны окончатые дефекты (7 и 9 мм)
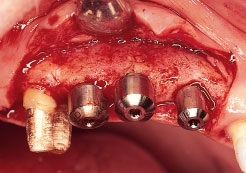
Рис. 2b. Раскрытие имплантатов через 6 мес, дефект полностью заполнен костной тканью
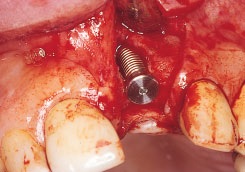
Рис. 3а. Наращивание кости сэндвич-методом у пациента № 3. Откинут лоскут, виден щелевидный дефект (13 мм)
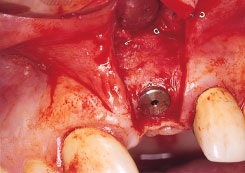
Рис. 3b. Раскрытие имплантата через 6 мес, дефект полностью заполнен костной тканью
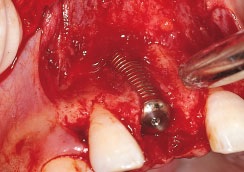
Рис. 4а. Наращивание кости сэндвич-методом у пациента № 4. Откинут лоскут, виден щелевидный дефект (15 мм)
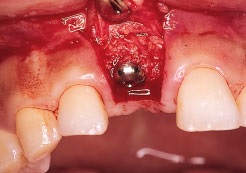
Рис. 4b. Раскрытие имплантата через 6 мес, дефект полностью заполнен костной тканью
ОБСУЖДЕНИЕ
Установка имплантатов в идеальном положении и с идеальным наклоном,35–39 может приводить к обнажению поверхности имплантатов из-за недостаточной ширины и (или) высоты гребня и часто, как следствие, к дезинтеграции таких имплантатов.16,28 Во избежание такого осложнения обычно требуется нарастить кость. При использовании принципов НРК можно проводить реконструкцию альвеолярного гребня не только до имплантации, но и одновременно с ней.40 Buser и соавт.29 нарастили гребень по ширине на 1,5–5,5 мм и пришли выводу, что направленная регенерация кости является эффективным методом наращивания кости. Впрочем, результаты последующих исследований отличались друг от друга, возможно, из-за различных использованных методик и материалов.15,41–57
Аутогенный костный трансплантат считается «золотым стандартом» среди материалов для наращивания кости, поскольку обладает остеогенными, остеокондуктивными и остеоиндуктивным свойствами. В то же время, объем внутриротовых источников кости ограничен, а забор кости увеличивает риск послеоперационной болезненности. Коммерчески доступные материалы (АДЛК, ГА) могут помочь преодолеть такую проблему. Впрочем, и эти материалы не лишены недостатков. Например, АДЛК имеет низкую механическую прочность и рассасывается быстрее, чем минерализованная лиофилизированная кость или гидроксиапатит. Последний напротив, рассасывается очень медленно. Применение сэндвич-методики для наращивания кости позволяет оптимально использовать качества каждого материала и барьерную функцию коллагеновой мембраны. Барьерная мембрана исключает проникновение клеток мягких тканей в толщу костного материала и препятствует его миграции, обеспечивая заживление без осложнений.2,58–64
Внутренний слой, представленный аутогенной костью, содержит жизнеспособные остеогенные клетки. Плотный контакт этого слоя с альвеолярным гребнем обеспечивает идеальные условия для миграции и пролиферации остеогенныхклеток и последующего замещения материала новой костью. Условия можно улучшить, нанеся поверх аутогенного трансплантата слой аллогенной кости. Аллогенные имплантаты человеческой минерализованной и деминерализованной кости широко используются для устранения костных дефектов, поскольку обладают остеокондуктивными и остеоиндуктивными свойствами.65–70 АДЛК быстро васкуляризуется и колонизируется остеогенными клетками и может стимулировать рост кости, что устраняет необходимость получения аутотрансплантата.71,72 Считается, что остеоиндуктивные свойства материала обеспечиваются сохранением КМП при деминерализации.67–69,73 При получении АДЛК происходит растворение минеральных составляющих кости в кислоте. В результате получается материал, состоящий из коллагена, неколлагеновых костных матричных протеинов, факторов роста и практически не содержащий минералов.73,74 Следовательно, при деминерализации обнажаются и, возможно, активируются индуцирующие образование кости белки, расположенные в костной матрице.22,75–79 В недавних исследованиях высказано предположение, что количества КМП в материале недостаточны для проявления остеоиндуктивных свойств.80–85
Для этих же целей можно использовать минерализованные формы костных материалов, например минерализованный аллогенный костный имплантат (Puros). Технология его изготовления отличается от стандартной возгонки в вакууме и заключается в обработке аллогенной кости уникальными растворителями, сохраняющими структуру тканей и инактивирующими вирусы. В ходе обработки структура кости повреждается меньше, чем при любом другом способе обработки, что обеспечивает отличную матричную и опорную функции.86 Исследования показали, что применение перекиси водорода в ходе обработки способно инактивировать все важные патогены (ВИЧ и вирусы гепатита), что обеспечивает безопасное клиническое использование материала.87 Гистологические исследования подтвердили, что биосовместимость кости, обработанной соответствующими растворителями, сопоставима с лиофилизированной костью.88 И хотя механизм замещения этого материала остается неясным, первые исследования продемонстрировали, что он не вызывает реакцию отторжения и высокоэффективно инициирует образование новой кости.89,90
Внешний слой костного материала, состоящий из плотного ГА, поддерживает пространство в ходе заживления. Бычий ГА (Bio-Oss) широко и эффективно используется для устранения пародонтальных дефектов и дефектов кости вокруг имплантатов, что было доказано во многих исследованиях.91–94
После заполнения дефекта материал накрывали резорбируемой коллагеновой мембраной, для исключения попадания клеток мягких тканей в рану. Использование барьерных мембран увеличивает количество новообразующейся кости.95–99 Lang и соавт.100 изучали зависимость количества образующейся альвеолярной кости при использовании нерезорбируемых мембран в зависимости от сроков заживления. Авторы доказали, что при удалении мембраны в период с 3-го по 5-й мес после ее установки можно получить от 0 до 60% максимально возможного объема, а при удалении с 6-го по 8-й мес – от 90 до 100%.100 Поэтому использование коллагеновых мембран более предпочтительно, поскольку они защищают область дефекта до завершения созревания кости и не требуют удаления. Коллагеновые мембраны более предпочтительны еще и из-за хорошей биосовместимости с тканями рта, гемостатических свойств и хемотаксического эффекта в отношении фибробластов, что способствует заживлению раны первичным натяжением.101 Коллаген является важной составляющей человеческого тела, а поэтому абсорбируется. Благодаря этому свойству можно получить удовлетворительные результаты наращивания костного гребня даже при обнажении мембраны в период заживления.102 В данном исследовании у одного пациента мембрана обнажилась через 2 недели после операции, тем не менее дефект был полностью устранен (рис. 1h).
Стабильность полученной при НКР кости необходимо оценивать после установки и нагрузки имплантатов. В ряде исследований было показано, что такая кость остается стабильной после начала нагрузки имплантатов, а коэффициент успеха имплантации сопоставим с таковым при имплантации в интактную кость.103–109 Похожие результаты были получены при устранении щелевидных костных дефектов в области имплантатов.110–114
Правильный выбор и строгое соблюдение протокола операции, адекватная обработка поверхности имплантата и устранение причины образования дефекта позволяют нарастить кость вокруг имплантата.115 Кроме того, описанную в настоящей статье сэндвич-методику можно использовать для улучшения исходно недостаточной костной поддержки имплантатов (т.е. при наличии стабилизированных костных дефектов) и для устранения периимплантита. Периимплантит характеризуется резорбцией кости с образованием кармана, сопровождающегося кровотечением при зондировании, экссудацией, и признаками продолжающейся резорбции кости, несмотря на проводимую терапию. Также сэндвич-методику можно применять для сохранения формы гребня при удалении зубов. Результаты НКР при периимплантите улучшаются при использовании, помимо резорбируемой мембраны, костного материала.116–118 Дальнейшая оценка эффективности сэндвич-методики для устранения упомянутых видов дефектов требует дополнительных исследований.
ВЫВОДЫ
Прогресс костных реконструктивных методик и потенциал использования барьерных мембран расширили показания к установке стоматологических имплантатов. В экспериментальных и клинических исследованиях было показано, что на окончательный результат влияет целый ряд факторов: тип используемых костных материалов и барьерных мембран, время заживления, форма и размер костных дефектов, обнажение мембраны. Вероятно, сэндвич-методика позволяет максимально задействовать возможности НКР, используя преимущества различных костных материалов. Многообещающие результаты, полученные нашей группой, побуждают к дальнейшим исследованиям для сравнения использованной методики с другими методами наращивания кости с проведением гистологического контроля.
Благодарность
Авторы выражают свою признательность д-рам Paulo Mascarenhas и Tatsumasa Itose за участие в ведении настоящих клинических случаев. Исследование частично финансировалось грантом студенческого исследовательского фонда пародонтологии Мичиганского университета.
ЛИТЕРАТУРА
- Gotfredsen K, Warrer K, Hjørting H, Karring T.: Effect of membranes and porous hydroxyapatite on healing in bone defects around titanium dental implants. An experimental study in monkeys. Clin Oral Implants Res 1991;2:172–178.
- Grunder U, Hürzeler MB, Schupbach P, Strub JR.: Treatment of ligature-induced peri-implantitis using guided tissue regeneration: A clinical and histologic study in the beagle dog. Int J Oral Maxillofac Implants 1993;8:282–293.
- Murray C, Holden R, Roachlan W.: Experimental and clinical study of the new growth of bone in a cavity. Am J Surg 1957;95:385–387.
- Hurley A.: The role of soft tissues in osteo-genesis. J Bone Joint Surg Am 1959;41:1243–1249.
- Engler WO, Ramfjord SP, Hiniker JJ.: Healing following simple gingivectomy. A tritiated thymidine radioautographic study. I. Epithelialization. J Periodontol 1966;37:293–303.
- Ramfjord SP, Engler WO, Hiniker JJ.: A radioautographic study of healing following simple gingivectomy. II. The connective tissue. J Periodontol 1966;37:179–189.
- Buser DA, Tontti M.: Clinical trials on implants in regenerated bone. Ann Periodontol 1997;2:329–342.
- Buser D, Dahlin C, Schenk R.: Guided Bone Regeneration in Implant Dentistry. Chicago: Quintessence, 1994.
- American Academy of Periodontology. Glossary of Periodontal Terms, ed 4. Chicago: AAP, 2001:1.
- Linghorne W.: The sequence of events in osteogenesis as studied in polyethylene tubes. Ann N Y Acad Sci 1960;xy:445.
- Melcher A, Dreyer CJ.: Protection of the blood clot in healing circumscribed bone defects. J Bone Joint Surg Br 1962;44: 424–435.
- Dahlin C, Sennerby L, Lekholm U, Lindé A, Nyman S.: Generation of new bone around titanium implants using a membrane technique: An experimental study in rabbits. Int J Oral Maxillofac Implants 1989;4:19–25.
- Seibert J, Nyman S.: Localized ridge augmentation in dogs: A pilot study using membranes and hydroxyapatite. J Periodontol 1990;61:157–165.
- Kostopoulos L, Karring T.: Guided bone regeneration in mandibular defects in rats using a bioresorbable polymer. Clin Oral Implants Res 1994;5:66–74.
- Nyman S, Lang NP, Buser D, Brägger U.: Bone regeneration adjacent to titanium dental implants using guided tissue regeneration: A report of two cases. Int J Oral Maxillofac Implants 1990;5:9–14.
- Wilson TG Jr, Buser D.: Advances in the use of guided tissue regeneration for localized ridge augmentation in combination with dental implants. Tex Dent J 1994;111:5,7–10.
- Von Arx T.: 5 years of guided bone regeneration (GBR) in implant dentistry. A report on the membrane symposium of 10 and 11 December 1993 at Basel [in German]. Schweiz Monatsschr Zahnmed 1994;104:494-496, 515–517.
- Shanaman RH.: A retrospective study of 237 sites treated consecutively with guided tissue regeneration. Int J Periodontics Restorative Dent 1994;14:292–301.
- Saadoun AP, Le Gall M.: Keys to success in implant osseointegration [in French]. Int J Dent Symp 1994;2:6–11.
- Rominger JW, Triplett RG.: The use of guided tissue regeneration to improve implant osseointegration. J Oral Maxillofac Surg 1994;52:106–112.
- Nevins M, Mellonig JT.: The advantages of localized ridge augmentation prior to implant placement: A staged event. Int J Periodontics Restorative Dent 1994;14:96–111.
- Aspenberg P, Goodman S, Toksvig-Larsen S, Ryd L, Albrektsson, T.: Intermittent micromotion inhibits bone ingrowth. Titanium implants in rabbits. Acta Orthop Scand 1992;63:141–145.
- Szmukler-Moncler S, Salama H, Reingewirtz Y, Dubruille JH.: Timing of loading and effect of micromotion on bone-dental implant interface: Review of experimental literature. J Biomed Mater Res1998;43:192–203.
- Brunski JB, Moccia AF Jr, Pollack SR, Korostoff E, Trachtcnberg Dl. The influence of functional use of endosseous dental implants on the tissue-implant interface. II. Clinical aspects. J Dent Res 1979;58:1970-1980.
- Brunski JB, Moccia AF Jr, Pollack SR, Korostoff E, Trachtenberg Dl.: The influence of functional use of endosseous dental implants on the tissue-implant interface. I.
Histological aspects. J Dent Res 1979;58:1953–1969. - Roberts WE, Smith RK, Zilberman Y, Mozsary PG, Smith RS.: Osseous adaptation to continuous loading of rigid endosseous implants. Am J Orthod 1984;86:95–111.
- Brunski JB.: Avoid pitfalls of overloading and micromotion of intraosseous implants. Dent Implantol Update 1993; 4(10):77–81.
- Wang HL, Al-Shammari K.: HVC ridge deficiency classification: A therapeuticaily oriented classification. Int J Periodontrcs Restorative Dent 2002;22:335–343.
- Buser D, Brägger U, Lang NP, Nyman S.: Regeneration and enlargement of jaw bone using guided tissue regeneration. Clin Oral Implants Res 1990;1:22–32.
- Frost HM.: The biology of fracture healing. An overview for clinicians. Part II. Clin Orthop 1989;248:294–309.
- Sableman E.: Biology, Biotechnology, and Biocompatibility of Collagen. Biocom-patibility of Tissue Analogs. Boca Raton, FL: CRC, 1985:27.
- Postlethwaite AE, Seyer JM, Kang AH.: Chemotactic atltraction of human fibro-blasts to type I, II, and III collagens and collagen-derived peptides. Proc Natl Acad Sci USA 1978;75:871–875.
- Zanetta-Barbosa D, Klinge B, Svensson H.: Laser Doppler flowmetry of blood perfusion in mucoperiosteal flaps covering membranes in bone augmentation and implant procedures. A pilot study in dogs. Clin Oral Implants Res 1993;4:35–38.
- Schenk RK, Buser D, Hardwick WR, Dahlin C.: Healing pattern of bone regeneration in membrane-protected defects: A histologic study in the canine mandible. Int J Oral Maxillofac Implants 1994;9:13–29.
- Kopp KC, Koslow AH, Abdo OS.: Predictable implant placement with a diagnostic/surgical template and ad¬vanced radiographic imaging. J Prosthet Dent 2003;89:611–615.
- Cehreli MC, Calis AC, SahinS.: A dual-purpose guide for optimum placement of dental implants. J Prosthet Dent 2002;88: 640–643.
- Wat PY, Chow TW, Luk HW, Comfort MB.: Precision surgical template for implant placement: A new systematic approach. Clin Implant Dent Relat Res 2002;4:33–92.
- Walton JN, Huizinga SC, Peck CC.: Implantangulation: A measurement technique, implant overdenture maintenance, and the influence of surgical experience. Int J Prosthodont 2001;14:523–530.
- Cehreli MC, Iplikcioglu H, Bilir OG.: The influence of the location of load transfer on strains around implants supporting four unit cement-retained fixed prostheses: In vitro evaluation of axial versus offet loading. J Oral Rehabil 2002;29: 394–400.
- Dahlin C, Lindé A, Gottlow J, Nyman S.: Healing of bone defects by guided tissue regeneration. Plast Reconstr Surg 1988; 81:672–676.
- Kohal RJ, Hürzeler MB.: Bioresorbable barrier membranes for guided bone regeneration around dental implants [in German]. Schweiz Monatsschr Zahnmed 2002;112:1222–1229.
- Ou G, Bao C, Liang X, Chao Y, Chen Z.: Histological study on the polyhydroxybutyric ester (PHB) membrane used for guided bone regeneration around titanium dental implants [in Chinese]. Hua Xi Kou Qiang Yi Xue Za Zhi 2000;18:215–218.
- Kohal RJ. Wirsching C, Bachle M.: Guided bone regeneration around dental implants using a bioabsor-bable membrane. A pilot investigation in experimental animals
[in German]. Schweiz Monatsschr Zahnmed 2001;111:1397–1405. - Ito K, Yamada Y, Ishigaki R, Nanba K, Nishida T, Sato S.: Effects of guided bone regeneration with non-resorbable and bioabsorbable barrier membranes on osseointegration around hydroxyapatite-coated and uncoated threaded titanium dental implants placed into a surgically-created dehiscence type defect in rabbit tibia: A pilot study. J Oral Sci 2001;43:61–67.
- Schlegel KA, Sindet-Pedersen S, Hoepffner HJ.: Clinical and histological findings in guided bone regeneration (GBR) around titanium dental implants with autogeneous bone chips using a new resorbable membrane. J Biomed Mater Res 2000;53:392–399.
- Chong WL, Chu SA, Dam JG, Ong KS.: Oral rehabilitation using dental implants and guided bone regeneration. Ann Acad Med Singapore 1999;28:697–703.
- Fiorellini JP, Engebretson SP, Donath K, Weber HP.: Guided bone regeneration utilizing expanded polytetrafluoroethylene membranes in combination with submerged and nonsubmerged dental implants in beagle dogs. J Periodontol 1998;69:528–535.
- Hürzeler MB, Quiñones CR, Schupbach P.: Guided bone regeneration around dental implants in the atrophic alveolar ridge using a bioresorbable barrier. An experimental study in the monkey. Clin Oral Implants Res 1997;8:323–331.
- Schlegel AK, Donath K, Weida S.: Histological findings in guided bone regeneration (GRR) around titanium dental implants with autogenous bone chips using a new resorbable membrane. J Long Term Eff Med Implants 1998;8:211–224.
- Stentz WC, Mealey BL, Gunsolley JC, Waldrop TC.: Effects of guided bone regeneration around commercially pure titanium and hydroxyapatite-coated dental implants. II. Histologic analysis. J Periodontol 1997;68:933–949.
- Stentz WC, Mealey BL, Nummikoski PV, Gunsolley JC, Waldrop TC.: Effects of guided bone regeneration around commercially pure titanium and hydroxyapatite-coated dental implants. I. Radiographic analysis. J Periodontol 1997;68:199–208.
- Hermann JS, Buser D.: Guided bone regeneration for dental implants. Curr Opin Periodontol 1996;3:168–177.
- Mattout P, Nowzari H, Mattout C.: Clinical evaluation of guided bone regeneration at exposed parts of Brånemark dental implants with and without bone allograft. Clin Oral Implants Res 1995;6:189–195.
- Danesh-Meyer MJ. Dental implants. Part II: Guided bone regeneration, immediate implant placement, peri-implantitis, failing implants. JNZ Soc Periodontol 1994;78:18–28.
- Gher ME, Quintero G, Assad D, Monaco E, Richardson AC.: Bone grafting and guided bone regeneration for immediate dental implants in humans. J Periodontol 1994;65:881–891.
- Sinclair G.: A comparison of two technique of bone regeneration: Bone grafting alone, and bone grafting with guided tissue regeneration in the successful replacement of two fractured teeth by dental implants. JNZ Soc Periodontol 1971;71:6–11.
- Hempton TJ, Fugazzotto PA.: Ridge augmentation utilizing guided tissue regeneration, titanium screws, freezedried bone, and tricalcium phosphate: Clinical report. Implant Dent 1994;3:35–37.
- Meffert RM. How to treat ailing and failing implants. Implant Dent 1992;1:25–33.
- Wachtel HC, Langford A, Bemimoulin JP, Reichart P. Guided bone regeneration next to osseointegrated implants in humans. Int J Oral Maxillofac Implants 1991;6:127-135.
- Artzi Z, Tai H, Chweidan H.: Bone regen¬eration for reintegration in peri-implant destruction. Compend Contin Educ Dent 1998;19:17-20,22-23,26–28.
- Hürzeler MB, Quiñones CR, Morrison EC, Caffesse RG.: Treatment of peri-implantitis using guided bone regeneration and bone grafts, alone or in combination, in beagle dogs. Part 1: Clinical findings and histologic observations. Int J Oral Maxillofac Implants 1995;10:474–484.
- Hürzeler MB, Quiñones CR, Schupback P, Morrison EC, Caffesse RG.: Treatment of peri-implantitis using guided bone regeneration and bone grafts, alone or in com¬bination, in beagle dogs. Part 2: Histologic findings. Int J Oral Maxillofac Implants I997;12:168-175.
- Persson LG, Ericsson I, Berglundh T, Lindhe J.: Guided bone regeneration in the treatment of periimplantitis. Clin Oral Implants Res 1996;7:366–372.
- von Arx T, Kurt B, Hardt N.: Treatment of severe periimplant bone loss using autogenous bone and a resorbable mem¬brane. Case report and literature review. Clin Oral Implants Res 1999;8:517–526.
- Urist MR. Bone: Formation by autoinduction. Science 1965;150(698): 893–899.
- Urist MR, Silverman BF, Buring K, Dubuc FL, Rosenberg JM.: The bone induction principle. Clin Orthop 1967;53:243-283.
- Urist MR, Dowell TA, Hay PH, Strates BS.: Inductive substrates for bone formation. Clin Orthop 1968;59:59-96.
- Urist MR, Iwata H. Preservation and biodegradation of the morphogenetic property of bone matrix. J Theor Biol 1973;38:155–167.
- Urist MR, Iwata H.: Ceccotti PL, et al. Bone morphogenesis in implants of insoluble bone gelatin. Proc Natl Acad Sci U S A 1973;70:3511–3515.
- Becker W, Becker BE, Caffesse R.: A comparison of demineralized freeze-dried bone and autologous bone to induce bone formation in human extraction sockets. J Periodontol 1994;65:1128–1133.
- Sassard WR, Eidman DK, Gray PMJ.: Analysis of spine fusion utilizing demineralized bone matrix. Presented at Western Orthopedic Association Meeting, August 1994,
Philadelphia. - An HS, Simpson JM, Glover JM, Stephany J.: Comparison between allograft plus demineralized bone matrix versus autograft in anterior cervical fusion. A prospective multicenter study. Spine 1995;20:2211–2216.
- Mellonig JT. Decalcified freeze-dried bone allograft as an implant material in human periodontal defects. Int J Periodontcs Restorative Dent 1984;4(6):40–55.
- Gazdag AR, Lane JM, Glaser D, Forster RA. Alternatives to autogenous bone graft: Efficacy and indications. J Am Acad Orthop Surg 1995;3:1–8.
- Schwartz Z, Mellonig JT, Carnes DLJr, et al. Ability of commercial demineralized freeze-dried bone allograft to induce new bone formation. J Periodontol 1996;67:918–926.
- Mellonig JT, Triplett RG. Guided tissue regeneration and endosseous dental implants. Int J Periodontics Restorative Dent 1993;13:108–119.
- Nevins M, Mellonig JT.% Enhancement of the damaged edentulous ridge io receive dental implants: A combination of allograft and The Gore-Tex membrane. Int J Periodontics Restorative Dent 1992;12:96–111.
- Werbitt MJ, Goldberg PV. The immediate implant: Bone preservation and bone regeneration. Int J Periodontics Restorative Dent 1992;12:206–217.
- Shanaman RH.: The use of guided tissue regeneration to facilitate ideal prosthetic placement of implants. Int J Periodontics Restorative Dent 1992;12:256–265.
- Tsai CH, Chou MY, Jonas M, Tien YT, Chi EY.: A composite graft material containing bone particles and collagen in osteoinduction in mouse. J Biomed Mater Res 2002;63:65–70.
- Paul BF, Horning GM, Hellstein JW, Schafer DR. The osteoinductive potential of demineralized freeze-dried bone allograft in human non-orthotopic sites: A pilot study. J Periodontol 2001;72:1064–1068.
- Schwartz Z, Weesner T, van Dijk S, et al.: Ability of deproteinized cancellous bovine bone to induce new bone formation. J Periodontol 2000;71:1258–1269.
- Boyan BD, Lohmann CH, Somers A, et al.: Potential of porous poly-D, L-lactide-coglycolide particles as a carrier for recombinant human bone morphogenetic protein-2 during osteoinduction in vivo. J Biomed Mater Res 1999;46:51–59.
- Becker W. Urist M, Becker BE, et al. Clinical and histologic observations of sites implanted with intraoral autologous bone grate or allografts. 15 human case reports. J Periodontol 1996;67:1025–5033.
- Piattelli A, Scarano A, Corigliano M, Piattelli M. Comparison of bone regeneration with the use of mineralized and demineralized freeze-dried bone allografts: A histological and histochemical study in man. Biomaterials 1996;17:1127–1131.
- Scharf H-P. Humane Tibialis-Anterior-Sehnen als Lösungs mittelkonserciertes Transplantat für den Kreuzbandersatz [thesis]. Ulm, Germany: Ulm University, 1990.
- Diringer H, Braig HR. Irtfectivity of unconventional viruses in dura mater. Lancet 1989;1(8635):439–440.
- Günther KP, Scharf H-P, Pesch H-J, Puhl W.: Osteointegration of solvent-preserved bone transplants in an animal model. Osteologie 1996;5:4-12.
- Dalkyz M, Ozcan A, Yapar M, Gokay N, Yuncu M.: Evaluation of the effects of different biomateriais on bone defects. Implant Dent 2000;9:226–235.
- Gapski R, Neiva R, Oh T, Wang H.: Histologic analyses of human hydroxyapatite grafting material in sinus elevation procedures: A case series. Int J Periodontics Restorative Dent {forthcoming).
- Camelo M, Nevins ML, Lynch SE, Schenk RK, Simian M, Nevins M.: Periodontal regeneration with an autogenous bone-Bio-Oss composite graft and a Bio-Gide membrane.
Int J Periodontics Restorative Dent 2001;21:109–119. - Fugazzotto PA.: GBR using bovine bone matrix and resorbable and nonresorbable membranes. Part 1: Histologic results. Int J Periodontics Restorative Dent 2003,23:361–369.
- Nevins ML, Camelo M, Lynch SE, Schenk RK, Nevins M. Evaluation of periodontal regeneration following grafting intrabony defects with Bio-Oss Collagen: A human histologic report. Int J Periodontics Restorative Dent 2003;23:9–17.
- Camelo M, Nevins ML, Schenk RK, et al.: Clinical, radiographic, and histologic evaluation of human periodontal defects treated with Bio-Oss and Bio-Gide. Int J
Periodontics Restorative Dent 1998;18:321–331. - Dogan N, Okcu KM, Ortakoglu K, Dalkiz M, Gunyadin Y. Barrier membrane and bone graft treatments of dehiscence-type defects at existing implant: A case report.
Implant Dent 2003;12:145–150. - Sottosanti J, Anson D.: Using calcium sulfate as a graft enhancer and membrane barrier [interview]. Dent Implantol Update 2003;14:1–8.
- Peled M, Machtei EE, Rachmiel A.: Osseous reconstruction using a membrane barrier following marginal mandibulectomy: An animal pilot study. J Periodontol 2002;73:1451–1456.
- Yamada S, Shima M, Kitamura H, Sugito H.: Effect of porous xenographic bone graft with collagen barrier membrane on periodontal regeneration. Int J Periodontics
Restorative Dent 2002;22:389–397. - Buser D, Dula K, Hirt HP, Schenk RK.: Lateral ridge augmentation using auto-grafts and barrier membranes: A clinical study with 40 partially edentulous patients. J
Oral Maxillofac Surg 1996;54:420–453. - Lang NP, Hämmerle CH, Brägger U, Lehmann B, Nyman SR.: Guided tissue regeneration in jawbone detects prior to implant placement. Clin Oral Implants
Res 1994;5:92–97. - Parodi R, Santarelli G, Carusi G.: Application of slowresorbing collagen membrane to periodontal and periimplant guided tissue regeneration. Int J Periodontcs
Restorative Dent 1996; 16:174–185. - Parodi R, Carusi G, Santarelli G, Nanni F.: Implant placement in large edentulous ridges expanded by GBR using a bioresorbable collagen membrane. Int J Periodontics
Restorative Dent 1998;18:266–275. - Buser D, Ruskin J, Higginbottom F, Hardwick R, Dahlin C, Schenk RK.: Osseointegration of titanium implants in bone regenerated in membrane-pro¬tected defects: A histologic study in the canine mandible. Int J Oral Maxillofac Implants 1995;10:666–681.
- Fritz ME, Jeffcoat MK, Reddy M. et al. Implants in regenerated bone in a primate model. J Peridontol 2001;72:703-708.
- Mayfield L, Skoglund A, Nobreus N, Attström R. Clinical arid radiographic evaluation, following delivery of fixed reconstructions, at GBR treated titanium fixtures. Clin Oral Implants Res 1998;9:292–302.
- Fugazzotto PA.: Report of 302 consecutive ridge augmentation procedures: Technical considerations and clinical results. Int J Oral Maxillofac implants 1998;13:358–368.
- Becker W, Dahlin C, Lekholm U, et al.: Five-year evaluation of implants placed at extraction and with dehiscences and fenestration defects augmented with ePTFE membranes: Results from a prospective multicenter study. Clin Implant Dent Relat Res 1999;1:27–32.
- Brunel G, Brocard D, Duffort JF, et al.: Bioabsorbable materials for guided bone regeneration prior to implant placement and 7-year follow-up: Report of 14 cases. J
Periodontol 2001;72:257–264. - Zitzmann NU, Schärer P, Marinello CP.: Long-term results of implants treated with guided bone regeneration: A 5-year prospective study. Int J Oral Maxillofac
Implants 2001;16:355–366. - Hämmerle CH, Lang NP.: Single stage surgery combining transmucosal implant placement with guided bone regeneration and bioresorbable materials. Clin Oral
Implants Res 2001;12:9–18. - Rosen PS, Reynolds MA. Guided bone regeneration for dehiscence and fenestration defects on implants using an absorbable polymer barrier. J Periodontol
2001;72:250–256. - Fugazzotto PA, Shanaman R, Manos T, Shectman R. Guided bone regeneration around titanium implants: Report of the treatment of 1,503 sites with clinical reentries.
Int J Periodontics Restorative Dent 1997;17:292–299. - Palmer RM, Smith BJ, Palmer PJ, Floyd PD, Johannson CB, Albrektsson T.: Effect of loading on bone regenerated at implant dehiscence sites in humans. Clin Oral ImplantsRes 1998;9:283–291.
- Lorenzoni M, Pertl C, Polansky R, Wegscheider W. Guided bone regeneration with barrier membranes—A clinical and radiographic follow-up study after 24
months. Clin Oral Implants Res 1999;10:16–23. - Jovanovic SA.: Diagnosis and treatment of peri-implant disease. Curr Opin Periodontol 1994;1:194–204.
- Nociti FH Jr, Caffesse RG, Sallum EA, Machado MA, Stefani CM, Sallum AW.: Clinical study of guided bone regeneration and/or bone grafts in the treat¬ment of
ligature-induced peri-implantitis defects in dogs. Braz Dent J 2001;12:127–131. - Nociti FH Jr, Machado MA, Stefani CM, Sailum EA, Sallum AW.: Absorbable versus nonabsorbable membranes and bone grafts in the treatment of ligatureinduced
peri-implantitis defects in dogs. Part I. A clinical investigation. Clin Oral Implants Res 2001;12:115–120. - Nociti FH Jr, Machado MA, Stefani CM, Sallum EA.: Absorbable versus nonabsorbable membranes and bone grafts in the treatment of ligature-induced peri-implantitis
defects in dogs: A histometric investigation. Int J Oral Maxillofac Implants 2001;16:646–652.
© Издательство «Индекс Медиа», 2004–2025. Все права защищены. Любое использование материалов или их фрагментов допускается только с письменного разрешения ООО «Индекс Медиа».