Использование аутогенного костного трансплантата, полученного на ветви нижней челюсти: методика наращивания кости
DMD
Частная практика (Милан, Италия).
© Издательство «Индекс Медиа», 2004–2025. Все права защищены. Любое использование материалов или их фрагментов допускается только с письменного разрешения ООО «Индекс Медиа».
В последние десятилетия эффективность замещения одного или нескольких зубов с помощью дентальных имплантатов не вызывает сомнений. Однако время от времени каждый стоматолог-хирург сталкивается с такими ситуациями, корда анатомические условия альвеолярного гребня не позволяют установить имплантаты. Это часто происходит при длительной адентии, которая приводит к выраженной атрофии кости. В таких случаях для достижения достаточной первоначальной стабильности имплантата и оптимального протезирования необходимо восстановление утраченого объема гребня.
Направленная тканевая регенерация (НТР) с использованием стружки или блоков аутогенной кости является эффективным методом наращивания высоты и (или) ширины альвеолярного гребня.1 Аутогенные костные трансплантаты интрамембранозного происхождения считаются «золотым» стандартом при проведении вмешательств, направленных на восстановление альвеолярного гребня. Интрамембранозное формирование кости характеризуется отсутствием промежуточной стадии формирования хряща.2,3 При необходимости получения небольшого объема костного трансплантата обычно используют внутриротовые донорские участки, например подбородок или ретромолярные области нижней челюсти. Однако предпочтительнее использовать именно ретромолярную область, поскольку вмешательство в этом участке относительно безопасно и вызывает меньший дискомфорт пациента в послеоперационном периоде.
Цель данной статьи заключается в описании способов получения костных блоков из ретромолярной области нижней челюсти, а также в демонстрации их эффективности на примере нескольких клинических случаев.
ПЛАНИРОВАНИЕ ПЕРЕД ПРОВЕДЕНИЕМ ХИРУРГИЧЕСКОГО ВМЕШАТЕЛЬСТВА
Критерии отбора пациента для трансплантации кости включают в себя подробный сбор анамнеза и тщательное обследование полости рта. Во избежание осложнений во время хирургического этапа и в ходе послеоперационного периода необходимо иметь полную информацию об общем состоянии здоровья пациента. Любые заболевания, лекарственные средства или деятельность (привычки), угнетающие иммунную систему или подавляющие способность к заживлению, такие, как декомпенсированный сахарный диабет и курение, могут стать причиной неудачи лечения. Обследование полости рта включает в себя оценку состояния зубов и анатомических особенностей мягких и твердых тканей. Рентгенографическое исследование необходимо для выявления дефектов гребня и анатомии верхней и нижней челюсти. Панорамная рентгенография и компьютерное томографическое (КТ) сканирование способствуют определению доступного для трансплантации объема кости.
Хирургическое вмешательство
Решение о хирургическом доступе к ветви нижней челюсти должно быть принято после тщательной пальпации кости, для того, чтобы определить точное расположение наружного косого гребня. Существует три варианта доступа к донорскому участку, отличающихся расположением рабочего разреза относительно зубов: внутрибороздковый, околобороздковый (субмаргинальный) или разрез по гребню.
Внутрибороздковый разрез
Внутрибороздковый разрез производят в области щечной бороздки естественных зубов. Такой разрез начинается с дистального края второго премоляра и продолжается вдоль вестибулярных поверхностей зубов в дистальном направлении до ретромолярной подушки, в области которой разрез переходит на середину гребня, и далее до наружного косого гребня. Такой разрез может быть выполнен при наличии всех моляров и при условии здорового состояния пародонта. Для облегчения проведения внутрибороздкового разреза и последующего наложения швов необходимо рассмотреть возможность применения методики, позволяющей сохранить сосочки. Разрез заканчивается в области восходящей ветви нижней челюсти, но не выше уровня окклюзионной плоскости, что позволяет снизить риск повреждения щечной артерии или экспозиции щечной жировой подушки (рис. 1).
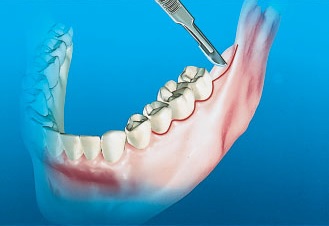
Рис. 1. Внутрибороздковый разрез проводят при наличии здоровых естественных зубов
Околобороздковый разрез
При наличии искусственных коронок или мостовидных протезов на жевательных зубах на стороне предполагаемого донорского участка рекомендуется проводить околобороздковый разрез. Для снижения вероятности образования рубцов и облегчения ушивания мягких тканей такой разрез следует проводить вдоль линии слизисто-десневого соединения. Данная локализация разреза позволяет избежать рассечения мышц на вестибулярной стороне нижней челюсти, что уменьшает риск послеоперационных осложнений и снижает дискомфорт после вмешательства. Кроме того, применение этого разреза снижает как вероятность возникновения рецессии на щечной стороне зубов, так и риск косметических осложнений и повреждения пародонта. Продление разреза в дистальном направлении на ветвь нижней челюсти проводят так же, как при проведении внутрибороздкового разреза (рис. 2).
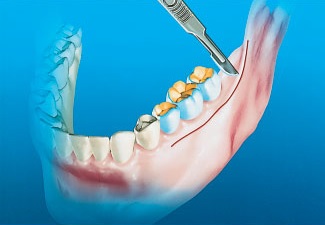
Рис. 2. При наличии ортопедических коронок выполняют околобороздковый разрез
Проведение разреза по гребню
Разрез по гребню показан при отсутствии жевательных зубов на стороне донорского участка. В области сохраненных зубов разрез может быть внутри- или околобороздковым, однако на дистальной поверхности наиболее дистального зуба разрез переходит на середину гребня и продолжается до ретромолярной подушки. При необходимости трансплантации кости в область адентии дистальнее премоляров для получения достаточного доступа можно ограничиться одним, достаточно длинным, разрезом по гребню. В этом случае не рекомендуется использовать внутри- или околобороздковый разрез (рис. 3).
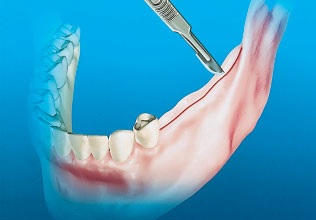
Рис. 3. При работе в области адентии проводят разрез по гребню
Сразу после проведения разреза от тела нижней челюсти отслаивают полнослойный лоскут и обнажают боковой фрагмент ветви нижней челюсти. С помощью специального ретрактора с зубцами лоскут откидывают выше вдоль наружного косого гребня до основания венечного отростка нижней челюсти.4 В области ветви может быть получен прямоугольный блок кортикальной Использование аутогенного костного трансплантата, полученного на ветви нижней челюсти: методика наращивания кости толщиной свыше 4 мм. Длина прямоугольного костного трансплантата может достигать 35 мм, но ширина обычно ненамного превышает 10 мм. Распил начинают у основания венечного отростка и проводят на 4–6 мм медиальнее наружной косой линии. Распил может быть продлен вплоть до дистальной границы в проекии первого моляра даже при наличии второго моляра. Передний и задний вертикальные распилы необходимо проводить перпендикулярно горизонтальному распилу, длина вертикальных распилов обычно не превышает 10 мм (рис. 4).
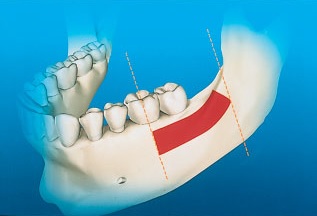
Рис. 4. Красным цветом отмечен донорский участок для получения костного трансплантата
Распил кости выполняют прямым наконечником с помощью небольшого фиссурного бора или осциллирующей пилы с обильной ирригацией. Во избежание травмы сосудисто-нервного пучка глубину распила увеличивают постепенно, медленно погружаясь в губчатую кость до появления выраженной кровоточивости. Нижний горизонтальный распил, объединяющий два вертикальных распила, легче всего провести шаровидным бором в прямом наконечнике. Поскольку в дистальных отделах нижней челюсти доступ и видимость ограничены, то для создания линии перелома в кортикальной кости создают только неглубокую канавку глубиной, равной половине диаметра шаровидного бора. Для полного отделения кортикального блока от подлежащей губчатой кости используют долото, после чего в верхний горизонтальный распил вводят более широкое долото или элеватор и, используя в качестве рычага, отделяют трансплантат от ветви нижней челюсти. Во время этого крайне деликатного этапа очень важно аккуратно поднимать трансплантат во избежание застревания сосудисто-нервного пучка в губчатой кости или перелома трансплантата (рис. 5).
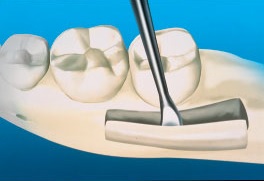
Рис. 5. Долото вставляют в горизонтальный распил и откалывают трансплантат от ветви нижней челюсти
Сразу после извлечения костный блок можно ненадолго поместить в стерильный физиологический раствор, чтобы хирург мог устранить кровотечение, которое может возникнуть в донорском участке. Как правило, кровотечение кратковременное и легко устраняется после аппликации резорбируемой коллагеновой губки и ушивания лоскутов в донорской области.
ТАКТИКА РАБОТЫ С КОСТНЫМ ТРАНСПЛАНТАТОМ И ПРИНИМАЮЩИМ ЛОЖЕМ
Костный аутотрансплантат можно использовать как в виде монокортикального блока, так и в виде стружки. Полученный фрагмент хорошо подходит для использования в виде накладки или вкладки для наращивания кости альвеолярного гребня. В качестве вкладки блок применяют при проведении синус-лифтинга с одновременной установкой имплантатов или без нее.5 Костную стружку можно использовать при направленной тканевой регенерации (НТР), а также при процедуре синус-лифтинга, для улучшения качества заполнения трансплантатом пространства полости. Стружку можно использовать как в чистом виде, так и в смеси с другими костными материалами.6 Принимающее ложе должно быть подготовлено еще до получения трансплантата. Это позволяет точно определить размеры костного дефекта и до минимума сократить время между получением и пересадкой костного трансплантата. Костный блок необходимо фиксировать к принимающему ложу, так, чтобы внутренняя сторона блока была обращена к ложу, которое предварительно перфорируют фиссурным бором для инициации кровотечения.1 Относительно недавно в литературе7 была предложена методика полной декортикации принимающего ложа для более быстрого доступа к сосудистой системе костного мозга и остеокластам через сеть костных канальцев.
Припасовку костного блока осуществляют с помощью незначительного выравнивания принимающего ложа и иссечения выступов самого трансплантата бором или костными кусачками. Края костного блока необходимо закруглить, чтобы предотвратить перфорацию лоскута. Для предотвращения подвижности костного блока его фиксируют титановыми шурупами небольшого диаметра, которые впоследствии извлекают. Подвижность костного трансплантата приводит к образованию фиброзной ткани между принимающим ложем и трансплантатом, что блокирует миграцию остеокластов и препятствует интеграции трансплантата и принимающего костного ложа.7
При отсутствии возможности идеальной припасовки трансплантата к принимающему ложу для заполнения небольших пустот можно использовать аутогенную костную стружку, полученную с помощью костных кусачек из того же донорского участка. При необходимости использования большего объема костной стружки из той же области можно получить и измельчить дополнительный небольшой костный блок. Для эффективного предотвращения прорастания соединительной ткани в толщу костной стружки можно использовать нерезорбируемую или резорбируемую мембрану. С целью достаточной мобилизации лоскута и пассивной его адаптации поверх области трансплантации, что способствует более быстрому и предсказуемому заживлению, часто необходимо рассечь надкостницу в основании лоскута.8
СПОСОБЫ НАЛОЖЕНИЯ ШВОВ
Ушивание лоскута в месте пересадки трансплантата можно осуществлять разными способами, выбор которых зависит от типа произведения разреза. При проведении внутрибороздкового разреза (с сохранением сосочков или без) рекомендуется накладывать простые узловые швы с формированием узелков в области сосочков. Этот способ ушивания достаточно прост и позволяет надежно стабилизировать лоскут. При использовании околобороздкового разреза для лучшей адаптации краев лоскута и предотвращения послеоперационного кровотечения из области разреза предпочтительно накладывать непрерывный замковый шов. При необходимости ушивания разреза, выполненного посередине гребня в участке адентии, можно накладывать любой из перечисленных видов швов. В случае проведения вмешательства с целью НТР в прилегающей трансплантации области рекомендуется накладывать горизонтальные матрацные швы, которые позволяют обеспечить лучшую адаптацию внутренних поверхностей краев лоскутов, препятствуют расхождению краев раны и предотвращают экспозицию мембраны в период заживления.8
ОБСУЖДЕНИЕ
Ветвь нижней челюсти является великолепным источником для получения аутогенного костного трансплантата для реконструкции альвеолярного гребня. Оказалось, что кость нижней челюсти имеет ряд биологических преимуществ, которые объясняются особенностями ее эмбрионального происхождения.9–11 Эмбриональное развитие нижней челюсти проходит в результате внутримембранного остеогенеза, в то время как суставные головки нижней челюсти развиваются с промежуточным этапом формирования хрящевой ткани (энхондральный остеогенез).12 Отмечено, что по сравнению с трансплантатами энхондрального происхождения трансплантаты, представленные костью внутримембранного происхождения, меньше подвергаются резорбции и быстрее реваскуляризуются,9–11 причем именно ранняя васкуляризация способствует сохранению объема блока.13 Существует предположение о том, что кость эктодермально-мезенхимального происхождения лучше интегрируется в челюстно-лицевом отделе из-за биомеханического сходства протоколлагена кости в донорской и принимающей областях.14 Ряд авторов считают, что повышенная выживаемость трансплантата внутримембранной кости объясняется его трехмерной структурой.15 Но несмотря на отмеченную меньшую резорбцию трансплантата внутримембранного происхождения, этот феномен не был доказан в ходе строгих научных исследований. Некоторые авторы предполагают, что степень резорбции костного блока, в первую очередь определяется соотношением его кортикального и губчатого слоев, а не эмбриональным происхождением донорской кости.16–18 Структура кортикальных костных трансплантатов подвергается очень незначительным изменениям, по мере их интеграции с принимающим ложем. В частности, кортикальный костный блок становится менее плотным, с более выраженными трабекулами и менее организованным.
Процесс заживления в области трансплантации имеет много общего с заживлением места перелома. Неваскуляризированный костный блок должен подвергнуться полному ремоделированию и васкуляризации. В пространстве между трансплантатом и принимающим ложем формируется кровяной сгусток, в который прорастают сосуды и проникают клетки-предшественники кости. Затем клетки-предшественники дифференцируются в остеобласты, и образуется волокнистая (незрелая) кость.19 В трансплантате также содержатся зрелые остеобласты и преостеобласты, участвующие в образовании кости. Однако эти клетки способны поддерживать процесс формирования кости в течение относительно непродолжительного периода. В дальнейшем процесс образования кости продолжается за счет полипотенциальных клеток трансплантата и клеток-предшественников губчатого вещества принимающего ложа.
Однако должна произойти полная перестройка трансплантата, и этот процесс начинается уже через несколько недель после его пересадки. Для полной перестройки блока могут понадобиться годы, а созревание кости зависит от механизма ремоделирования. Часть кости может резорбироваться для создания пространства для костного мозга. В ходе этого процесса прекращается образование остеобластов и зрелой кости, что обеспечивает сохранение необходимого пространства. Формирование кости требует достаточного кровоснабжения и механической стабильности блока. Для жесткой фиксации трансплантата используют титановые шурупы. Кроме того, следует избегать использования съемного протеза, который может оказывать давление на трансплантат.
После миграции макрофагов в центр раны развивающаяся сосудистая сеть начинает выполнять функцию дренажной системы, выводя метаболиты и продукты распада. Необходимость в кислороде внутри сгустка превышает его снабжение в результате отсутствия кровеносных сосудов и приводит к гипоксии, которая приводит к хемотаксису эндотелиальных и мезенхимальных клеток. Ангиогенез начинается с посткапиллярных венул, где эндотелиальные клетки разрушают субэндотелиальную базальную мембрану и мигрируют для того, чтобы образовать полые зародыши капилляров. Наконец, популяции клеток фибробластов секретируют ретикулярный матрикс для обеспечения механической поддержки формирующейся сосудистой системы.20 Низкое напряжение кислорода, возникающее в результате нарушения кровоснабжения, может приводить к экспрессии генов околососудистых клеток, вызывающих формирование фиброзной ткани и отложение волокнистого хряща.7 В результате процесса остеоиндукции образуется матрикс, который через 4 мес на верхней челюсти и 6 мес на нижней позволяет трансплантату выдерживать функциональные нагрузки. Именно поэтому рекомендованный период заживления составляет от 4 до 6 мес. Более длительный период заживления для нижней челюсти объясняется относительно медленным формированием адекватного соединения между трансплантатом и более плотным кортикальным слоем принимающей кости.6
Несмотря на возможность повреждения щечного нерва в результате проведения распила вдоль косого наружного гребня, сообщения о потере чувствительности слизистой щеки после операции достаточно редки, причем большинство из этих случаев остаются незамеченными пациентами.21 Повреждение нижнего альвеолярного нерва является одним из наиболее грозных осложнений процедуры получения трансплантата с ветви нижней челюсти. Во избежание травмы нерва необходимо точно представлять анатомию нижнечелюстного канала. Вертикальное расстояние между верхней границей канала и поверхностью наружного косого гребня в среднем составляет 7 мм в области вторых моляров, 11 мм в области третьих моляров и 14 мм у основания венечного отростка.22 Наибольшее расстояние от щечной поверхности гребня до нижнечелюстного канала определяется в области дистальной половины первого моляра (4,05 мм).23 Поэтому вертикальный распил кости в переднем отделе следует производить именно в этом участке.
Некоторые авторы рекомендуют использовать мембраны для предотвращения резорбции костного трансплантата.1,24 Однако у этой методики есть и свои недостатки. Достаточно часто происходит преждевременная экспозиция резорбируемой или нерезорбируемой мембраны, что может быть вызвано ушиванием лоскутов над мембраной и нарушением их васкуляризации. Мембрана препятствует прикреплению мягких тканей к подлежащей кости во время периода заживления, что приводит к расхождению краев раны под влиянием натяжения мышц.25,26 В результате происходит инфицирование мембраны и операционного поля, что ухудшает заживление.27–30 По этой причине нецелесообразно накрывать мембраной монокортикальный костный трансплантат, а резорбцию кости можно нивелировать с помощью использования трансплантата большей толщины. Применение мембраны может быть оправдано только в случае использования костной стружки вместе с костным блоком или отдельно для устранения небольших дефектов. При устранении значительных дефектов рекомендуется использовать только костные блоки. Кроме того, следует помнить, что риск экспозиции мембраны возрастает при наличии крупных дефектов25 (рис. 6–13).
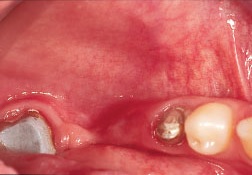
Рис. 6. Тонкий гребень нижней челюсти не позволяет установить имплантаты
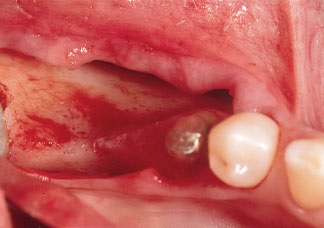
Рис. 7. После откидывания полнослойного лоскута обнажается узкий альвеолярный гребень
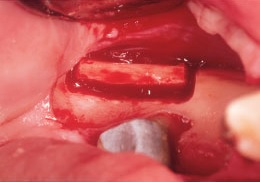
Рис. 8. С этой же стороны нижней челюсти получают костный трансплантат
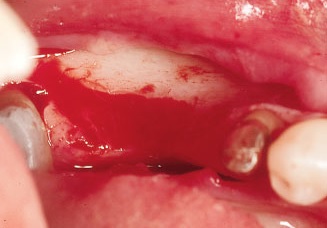
Рис. 9. Шаровидным бором проводят декортификацию принимающего ложа
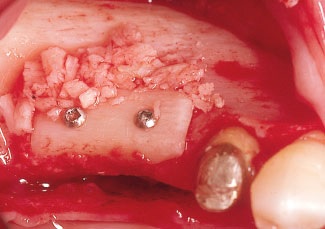
Рис. 10. Костный трансплантат надежно фиксируют к принимающему ложу двумя шурупами и заполняют пустоты между ними костной стружкой
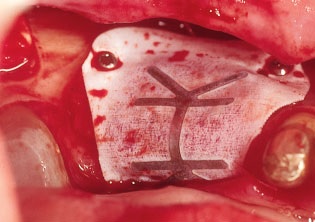
Рис. 11. Для предотвращения прорастания соединительной ткани в пространство между блоком и принимающим ложем трансплантат накрывают нерезорбируемой мембраной
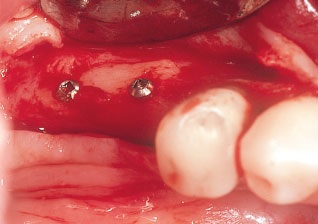
Рис. 12. Вид через 6 мес после операции. Трансплантат великолепно интегрировался с принимающим костным ложем
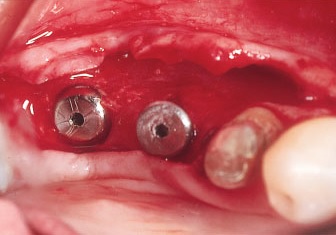
Рис. 13. Два имплантата установлены в области проведенной трансплантации
Экспозиция костного блока во время периода заживления может произойти даже без использования мембраны. Срок раскрытия мембраны может оказаться решающим фактором, определяющим результаты процедуры трансплантации кости. Реваскуляризация является динамическим процессом, который зависит от многих факторов, поэтому срок окончательного приживления костного блока определить достаточно сложно. Экспозиция трансплантата до его реваскуляризации может привести к инфицированию блока. Более поздняя экспозиция мембраны не обязательно приводит к некрозу трансплантата или препятствует его интеграции.31–33 Автор данной статьи в случае экспозиции мембраны снимает слой обнаженной кортикальной кости алмазным шаровидным бором, что способствует вторичному приживлению слизистой. Эту процедуру можно повторить несколько раз в зависимости от площади обнаженного участка кости.
ВЫВОДЫ
Пересадка аутогенного костного трансплантата с ветви нижней челюсти для восстановления объема альвеолярного гребня с целью последующей установки имплантатов или проведения синус-лифтинга имеет ряд преимуществ. Для приживления трансплантата необходим небольшой период (около 4–6 мес). Кроме того, трансплантаты, представленные плотной костью (I или II типа), подвергается незначительной резорбции и обеспечивают высокую первичную стабильность имплантатов. Процедура получения костного блока с ветви нижней челюсти не вызывает значительного дискомфорта и болезненности в послеоперационном периоде. Еще одно преимущество использования ветви в качестве донорского участка заключается в близком расположении ее к принимающему ложу в дистальном отделе альвеолярного гребня. Однако у некоторых пациентов трудно обеспечить достаточную визуализацию операционного поля, что ограничивает размер и форму костного трансплантата.
Благодарность
Автор выражает глубокую благодарность д-рам Стефано Грацису и Ули Грюндеру за помощь в работе над данной статьей.
ЛИТЕРАТУРА
- Buser D, Dahlin C, Schenk RK: Guided Tissue Regeneration in Implant Dentistry. Chicago: Quintessence, 1994.
- D’addona A, Nowzari H: Intramembranous autogenous osseous transplants in aesthetic treatment of alveolar atrophy. Periodontol 2000 2001 ;27:148–161.
- Smith JD, Abramson M: Membranous vs endochondral bone autografts. Arch Otolaryngol 1974;99:203–205.
- Misch CM: Comparison of intraoral donor sites for onlay grafting prior to implant placement. Int J Oral Maxillofac Implants 1997;12:767–776.
- Hirsch JM, Ericsson I: Maxillary sinus augmentation using mandibular bone grafts and simultaneous installation of implants. A surgical technique. Clin Oral Implants Res 1991;2:91–96.
- Moy P, Palacci P: Minor bone augmentation procedure. In: Palacci P (ed). Esthetic Implant Dentistry. Chicago: Quintessence, 2001:137–158.
- Zeiter DJ, Reis WL, Sanders JJ: The use of a bone block graft from the chin for alveolar ridge augmentation. Int J Periodontics Restorative Dent 2000;20:619–627.
- Tinti C, Benfenati SP, Polizzi G: Vertical ridge augmentation: What is the limit? Int J Periodontics Restorative Dent 1996;16:619–627.
- Zins JE, Whitaker LA.: Membranous versus endochondral bone: Implications for craniofacial reconstruction. Plast Reconstr Surg 1983;72:778–785.
- Linn KY, Barlett SP, Yaremchuk MJ, Grossman RF, Whitaker LA.: The effect of rigid fixation on the survival of onlay bone grafts: An experimental study. Plast Reconstr Surg 1990;86:449–456.
- Rabie ABM, Dan Z, Samman N.: Ultrastructural identification of cells involved in the healing of intramembranous and endochondral bones. Int J Oral Maxillofac Surg 1996;25:383–388.
- Kusiak JF, Zins JE, Whitaker LA.: The early revascularization of membranous bone. Plast Reconstr Surg 1985;76:510–516.
- Hardesty RA, Marsh JL.: Craniofacial onlay bone grafting: A prospective evaluation of graft morphology, orientation and embryonic, origin. Plast Reconstr Surg 1990;85:5–14.
- Koole R, Bosker H, van der Dussen FN. Late secondary autogenous bone grafting in cleft patients comparing mandibular (ectomesenchymal) and iliac crest (mesenchymal) grafts. J Craniomaxillofac Surg 1989;17(suppl 1):28-30.
- Manson PN.: Facial bone healing and bone grafts. A review of clinical physiology. Clin Plast Surg 1994;21:331–348.
- Ozaki W, Buchman SR.: Volume maintenance of onlay bone grafts in the craniofacial skeleton: Micro-architecture versus embryologic origin. Plast Reconstr Surg 1998;102:291–299.
- Buchman SR, Ozaki W.: The ultrastructure and resorptive pattern of cancellous onlay bone grafts in the craniofacial skeleton. Ann Plast Surg 1999;43:49–56.
- Ozaki W, Buchman SR, Goldstei SA, Fyhrie DP.: A comparative analysis of the rnicroarchitecture of cortical membranous and cortical endochondral onlay bone grafts in the craniofacial skeleton. Plast Reconstr Surg 1999;104:139–147.
- Boyne PJ. Histologic response of bone to sectioning by high-speed rotary instruments. J Dent Res 1996;45:270–276.
- Davies JE, Hosseini MM.: Histodynamics of endosseous wound healing. In: Davies JE (ed). Bone Engineering, ed 1. Toronto: em squared, 2000:1–14.
- Hendy CW, Smith KG, Robinson PP. :Surgical anatomy of the buccal nerve. Br J Oral Maxillofac Surg 1996;43:457–460.
- Smith BR, Rajchel JL.: Anatomical considerations in mandibular ramus osteotomies. In: Bell WH (ed). Modern Practice in Orthognathic and Reconstructive Surgery. Philadelphia: Saunders, 1992:2347–2360.
- Rajchel J, Ellis E III, Fonseca RJ.: The anatomical location of the mandibular canal: Its relationship to the sagittal ramus osteotomy. Int J Adult Orthod Orthognath Surg 1986;1:37–47.
- Buser D, Dula K, Hirt HP, Schenk R.: Lateral ridge augmentation using autografts and barrier membranes: A clinical study with 40 partially edentulous patients. J Oral Maxillofac Surg 1996;54:420–432.
- Buser D, Dula K, Belser UC, Hirt HP, Berthold H.: Localized ridge augmentation using guided bone regeneration. I. Surgical procedure in the maxilla. Int J Periodontics Restorative Dent 1993;13:29–45.
- Buser D, Dula K, Belser UC, Hirt HP, Berthold H.: Localized ridge augmentation using guided bone regeneration. II. Surgical procedure in the mandible. Int J Periodontics Restorative Dent 1995;15:10–29.
- Nowzari H, Slots J.: Microorganisms in polytetrafluoroethylene barrier membranes for guided tissue regeneration. J Clin Periodontol 1994;21:203–210.
- Simion M, Baldoni M, Rossi P, Zaffe D.: A comparative study of the effectiveness of e-PTFE membranes with and without early exposure during the healing period. Int J Periodontics Restorative Dent 1994;14:167–180.
- Simion M, Maglione M, Lamoni F, Scarano S, Piattelli A, Salvato A.: Bacterial penetration through Resolut resorbable membrane in vitro. A histological and scanning electron microscopic study. Clin Oral Implants Res 1997;8:23–41.
- Simion M, Scarano A, Gionso L, Piattelli A.: Guided bone regeneration using resorbable and nonresorbable membranes: A comparative histotologic study in humans. Int J Oral Maxillofac Implants 1996;11:735–742. Chiapasco M, Abati S, Romeo E, Vogel G.: Clinical outcome of autogenous bone blocks or guided bone regeneration with e-PTFE membranes for the reconstruction of narrow edentulous ridges. Clin Oral implants Res 1999;10:278–288.
- Lozano AJ, Cestero HJ, Salyer KE.: The early revascularization of onlay bone grafts. Plast Reconstr Surg 1976;99:203–205.
- Proussaefs P, Lozada J, Klinman A, Rohrer MD.:The use of ramus autogenous block grafts for vertical alveolar ridge augmentation and implant placement: A pilot study. Int J Oral Maxillofac Implants 2002;17:238–248.
© Издательство «Индекс Медиа», 2004–2025. Все права защищены. Любое использование материалов или их фрагментов допускается только с письменного разрешения ООО «Индекс Медиа».