Биоматериалы для реконструктивного устранения внутрикостных пародонтальных дефектов. Часть 2: направленная тканевая регенерация, биологические средства и комбинированная терапия
DMD, MS, PhD
Профессор, пародонтологическая клиника Бернского университета (Берн, Швейцария).
DMD, MS, PhD
Секция пародонтологии отделения консервативной стоматологии и пародонтологии университета Йогана Гуттенберга (Майнц, Германия).
Направленная тканевая регенерация (НТР)
Биологические принципы НТР основаны на экспериментальных исследованиях, доказывающих, что клетки-предшественники, формирующие новый цемент с врастающими в него коллагеновыми волокнами (т.е. новое соединительнотканное прикрепление), находятся в пародонтальной связке. Механический барьер, отграничивающий пародонтальный дефект, препятствует заполнению его соединительной тканью и эпителием, а также способствует стабилизации кровяного сгустка. Впоследствии область дефекта и поверхность корней заселяется клетками со стороны интактной пародонтальной связки и альвеолярной кости (Nyman et al., 1982; Gottlow et al., 1984; Karring et al., 1993).
Первой клинически испытанной мембраной является Миллипор (Millipore®), затем появилась нерезорбируемая мембрана из расширенного политетрафторэтилена (р-ПТФЭ) (Nyman et al., 1982; Gottlow et al., 1984, 1986; Karring et al., 1993). Сообщение о первом клиническом случае использования принципа НТР было опубликовано Nyman и соавт. (1982). Глубокий внутрикостный дефект в области нижнего резца устранили с помощью мембраны Миллипор. Ранее этот зуб планировали удалить из-за выраженной деструкции аппарата прикрепления. После удаления грануляционной ткани глубина пародонтального дефекта составила 11 мм. Мембрану установили таким образом, чтобы она полностью перекрывала границы внутрикостного дефекта и выходила на 2–3 мм на поверхность окружающей кости. Гистологическое исследование, проведенное через 3 месяца после операции, показало образование нового цемента и прикрепленных к нему коллагеновых волокон на поверхности корня, покрытой до лечения зубным налетом.
В более позднем исследовании Gottlow и соавт. (1986) устранили 12 внутрикостных дефектов, используя методику НТР. Гистологическое исследование, проведенное в пяти из 12 случаев, показало формирование значительного объема новых цемента, пародонтальной связки и кости, который, однако, сильно отличался у разных пациентов. Авторы считают, что количество регенерировавших тканей зависело от остаточного объема пародонтальной связки, морфологических особенностей дефекта, хирургического протокола и бактериальной контаминации мембраны. Полученные результаты позже нашли подтверждение в ходе контролируемых исследований с участием животных и людей (Pontoriero et al., 1992; Selvig et al., 1993). Было доказано, что использование принципа НТР позволяет предсказуемо достигать образования нового соединительнотканного прикрепления и новой альвеолярной кости при устранении внутрикостных дефектов и дефектов в области нижних зубов с вовлечением бифуркации II класса.
При использовании нерезорбируемых мембран из р-ПТФЭ требуется вторая операция для ее удаления, что может привести к повреждению новообразованных тканей. Типичным осложнением применения нерезорбируемых мембран из р-ПТФЭ является обнажение мембраны с последующей бактериальной контаминацией или даже инфекционным поражением тканей в области операции. Для уменьшения частоты такого осложнения были разработаны мембраны из коллагена, полимеров молочной кислоты и других синтетических рассасывающихся полимеров.
Контролируемые клинические исследования доказали, что использование резорбируемых и нерезорбируемых мембран позволяет получить сопоставимые результаты с точки зрения уменьшения глубины карманов при зондировании, увеличения клинического прикрепления и рентгенологических признаков ремоделирования кости (Caffesse et al., 1997; Laurell et al., 1994; Christgau et al., 1995; Eickholz et al., 1998). Синтетические мембраны расщепляются в результате гидролиза и метаболизируются в цикле Кребса с образованием углекислого газа и воды. В исследованиях на животных гистологически доказано образование нового соединительнотканного прикрепления и костной ткани (Gottlow et al., 1994; Caffesse et al., 1994; Hürzeler et al., 1997). Аналогичные результаты были получены и в других клинических исследованиях (Sculean et al., 1999a и 1999b) (рис. 1–3).
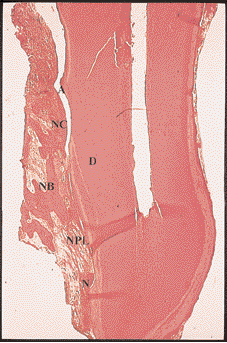
Рис. 1. Заживление внутрикостного дефекта человека после лечения с использованием резорбируемой мембраны. Заживление характеризуется формированием нового цемента (НЦ), новой пародонтальной связки (НПС) и новой кости (НК). Д – дентин, Н – насечка, А – артефакт (окраска гематоксилин-эозином, увеличение в 25 раз)
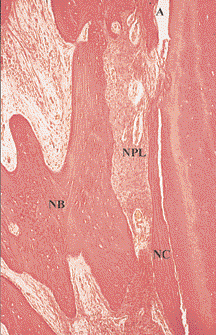
Рис. 2. Более сильное увеличение средней части дефекта, показанного на Рис. 1. Хорошо визуализируются сформированные новый цемент (НЦ), новая пародонтальная связка (НПС) и новая кость (НК). А – артефакт (окраска гематоксилин-эозином, увеличение в 150 раз)
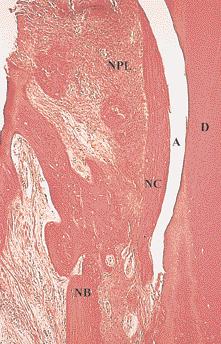
Рис. 3. Более сильное увеличение корональной части дефекта, показанного на Рис. 1. Очевидно образование нового цемента (НЦ), новой пародонтальной связки (НПС) и новой кости (НК). Д – дентин, А – артефакт (окраска гематоксилин-эозином, увеличение в 150 раз)
Сравнительный мета-анализ клинических исследований, посвященных оценке эффективности нерезорбируемых и резорбируемых мембран при устранении внутрикостных дефектов, не выявил статистически значимых различий между ними (Karring et al., 2003). Увеличение клинического прикрепления при использовании нерезорбируемых мембран при устранении 351 внутрикостного дефекта составило в среднем 3,7 мм. Увеличение клинического прикрепления при использовании резорбируемых мембран при устранении 591 внутрикостного дефекта составило в среднем 3,6 мм. Тщательный анализ показал, что клиническое прикрепление увеличилось на 2–3 мм в 29,2% случаев, на 4–5 мм в 35,4% случаев, на 6 мм и более в 24,9%, прикрепление увеличилось менее чем на 2 мм в 10,5% случаев, в двух случаях уровень прикрепления остался без изменений. Таким образом, использование направленной тканевой регенерации позволяет предсказуемо получать более благоприятные клинические результаты по сравнению с лоскутными манипуляциями. Такой вывод подтверждается анализом 11-ти контролируемых рандомизированных клинических исследований, в которых сравнивали эффективность НТР и традиционных лоскутных операций. В девяти из 11-ти исследований НТР позволила статистически достоверно увеличить уровень прикрепления больше, чем при лоскутных манипуляциях. По данным всех 11 исследований среднее увеличение уровня клинического прикрепления при использовании НТР составило 3,3±1,8 мм, а при лоскутных операциях – 2,1±1,5 мм (Karring et al., 2003). В систематическом обзоре Needlemann и соавт. (2002) выявили, что НТР более эффективно, чем открытый кюретаж увеличивает уровень клинического прикрепления.
Кондиционирование поверхности корня
Около 30 лет назад было сделано предположение, что удаление бактериального налета и эндотоксинов с поверхности корня, а также деминерализация поверхности корня для обнажения коллагена дентина способствуют образованию нового цемента посредством дифференцировки мезенхимальных клеток прилегающих тканей в цементобласты. Обнажение коллагеновых волокон дентинного матрикса может улучшить адгезию сгустка крови к поверхности корня и способствовать миграции фибробластов (Stahl et al., 1971). Несколько авторов продемонстрировали формирование у пациентов нового соединительнотканного прикрепления после проведения лоскутной операции и деминерализации поверхности корня лимонной кислотой (Frank et al., 1983; Stahl et al, 1991; Cole et al., 1980). Cole и соавт. (1980) привели гистологические доказательства формирования новых цемента, пародонтальной связки и альвеолярной кости при устранении внутрикостных дефектов с помощью лоскутной операции и деминерализации поверхности корня лимонной кислотой.
В нескольких исследованиях на животных была продемонстрирована регенерация пародонта после деминерализации поверхности корня лимонной кислотой или тетрациклином, однако во многих случаях авторы обнаружили анкилоз или резорбцию корня (Bogle et al., 1981; Magnusson et al., 1985). При деминерализации поверхности корня 24% раствором ЭДТА происходит обнажение коллагеновых волокон дентинного матрикса без некроза прилежащих мягких и твердых тканей (Blomlöf et al., 1996a и 1996b). В контролируемых клинических исследованиях не удалось выявить преимуществ хирургических и нехирургических пародонтологических вмешательств с деминерализацией поверхности корня лимонной кислотой или ЭДТА перед аналогичными вмешательствами без деминерализации корня (Moore et al., 1987; Blomlöf et al., 2000а и 2000b).
Факторы роста
Факторами роста называют группу полипептидов, вызывающих различные эффекты, например, пролиферацию, хемотаксис, дифференцировку, синтез внеклеточных матричных белков (Terranova и Wikesjö, 1987). Пролиферация и миграция клеток пародонтальной связки, синтез внеклеточных белков, дифференцировка цементобластов и остеобластов являются необходимыми условиями регенерации пародонта. Резонно было предположить, что местное применение факторов роста может улучшить регенерацию тканей пародонта. В гистологическом исследовании на собаках изучали эффективность устранения естественных пародонтальных дефектов при использовании комбинации тромбоцитарного фактора роста (PDGF) и инсулиноподобного фактора роста (IGF) одновременно с лоскутной операцией (Lynch et al., 1989 и 1991). В основной группе было отмечено образование цемента, пародонтальной связки и кости, а в контрольной группе (только лоскутная операция) обнаружили только формирование прикрепленного эпителия, т.е. не произошло регенерации пародонта. Похожие результаты были получены при устранении искусственных пародонтальных дефектов у обезьян при использовании комбинации PDGF и IGF (Rutherford et al., 1992; Giannobile et al., 1994, 1996). В клиническом исследовании для устранения пародонтальных внутрикостных дефектов и дефектов с вовлечением бифуркации II класса использовали PDGF и IGF. Через 9 месяцев значительное увеличение объема кости наблюдали только в областях использования комбинации факторов роста (Howell et al., 1997). Для получения окончательных выводов об эффективности использования факторов роста необходимы дальнейшие контролируемые клинические исследования.
Костные морфогенетические протеины (КМП) обладают остеоиндуктивным потенциалом, т.е. они способны стимулировать дифференциацию мезенхимальных клеток в костеобразующие клетки (Wozney et al., 1998). В нескольких гистологических исследованиях на животных была продемонстрирована регенерация пародонта при использовании КМП для устранения дефектов с вовлечением бифуркаций (Sigurdsson et al., 1995; Ripamonti et al., 1994; Jepsen и Terheyden, 2002).
Тем не менее, для оценки возможной роли КМП в устранении пародонтальных дефектов необходимы гистологические исследования на людях и контролируемые клинические исследования.
Таблица 1. Доказательства регенерации пародонта в области внутрикостных дефектов, полученные на основании гистологических исследований, рандомизированных контролируемых исследований (по сравнению с открытым кюретажем), по данным мета-анализа и (или) систематических обзоров

ГА – гидроксиапатит, ЭМП – эмалевые матричные протеины, ФР – факторы роста, *рч-ТФР в комбинации с АДЛК, n/a – данные отсутствуют
Таблица 2. Средние показатели ГКЗ, УКП и степени заполнения дефекта в основной и контрольной (открытый кюретаж) группах по данным мета-анализа

*Needleman I, Tucker R, Giedrys-Leeper E, Worthington H. A systematic review of guided tissue regeneration for periodontal infrabony defects. J Periodont Res 2002; 37: 380–388.
**Trombelli L, Heitz-Mayfield L, Needleman I, Moles D, Scabbia A. A systematic review of graft materials and biological agents for periodontal intraosseous defects. J Clin Periodontol 2002; 29(Suppl. 3): 117–135.
Эмалевые матричные протеины
Результаты фундаментальных исследований доказали ключевую роль эмалевых матричных протеинов (ЭМП) в развитии цемента, пародонтальной связки и альвеолярной кости (Hammarström, 1997). Биологический принцип действия ЭМП основан на том, что они (особенно, амелогенины) играют решающую роль в цементогенезе и могут имитировать процессы, происходящие при развитии тканей пародонта (Hammarström, 1997). ЭПМ выделяют из зачатков зубов молочных поросят, очищают и подвергают лиофилизации (Hammarström, 1997). Эмалевые матричные протеины чрезвычайно гидрофобны, поэтому для применения им придают водорастворимые свойства, смешивая с носителем – пропиленгликоль альгинатом (ПГА) (Gestrelius et al., 1997а). Исследования in vitro доказали, что ЭМП не только вызывают цементогенез, но и подавляют пролиферацию эпителия (Gestrelius et al., 1997b; Kawase et al., 2000). Кроме того, ЭМП способствуют высвобождению аутогенных факторов роста из фибробластов пародонтальной связки (Lyngstadaas et al., 2001). Поэтому одной из причин эффективности ЭМП в области пародонтальной раны может быть секреция факторов роста (Lyngstadaas et al., 2001). Иммуногистохимические исследования на людях на людях показывают, что ЭМП можно обнаружить на поверхности корней зубов в течение 4 недель после нанесения (Sculean et al., 2002а). Кроме того, оказалось, что ЭМП обладают определенным антимикробным эффектом, в частности, было отмечено снижение бактериальной адгезии после их применения (Van der Paul et al., 2000; Sculean et al., 2001a; Spahr et al., 2000; Arweiler et al., 2002). В исследовании ex vivo, включавшем 24 пациентов с хроническим пародонтитом, были получены образцы четырехдневного зубного налета, которые разделили на пять равных частей (Sculean et al., 2001a). Каждую часть смешали с одним из следующих растворов (по 5 мл): 1) физиологический раствор; 2) водный раствор ЭМП; 3) ПГА раствор ЭМП; 4) ПГА; 5) раствор хлоргексидина биглюконата. Жизнеспособность микрофлоры зубного налета оценивали с помощью флюоресцентной микроскопии. ПГА раствор ЭМП оказывал выраженное антимикробное действие, обусловленное, в основном, ПГА. Дальнейшие исследования показали, что препарат ЭМП ингибирует рост специфических бактерий: Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis и Prevotella intermedia. Через 24 часа после нанесения ЭМП ни одной колонии описанных бактерий получить не удалось (Spahr et al., 2001; Newman et al., 2003), однако ЭМП не подавляют грам-положительные бактерии.
Гистологические исследования на животных также подтверждают регенерацию пародонта при использовании ЭМП (Hammarström et al., 1997; Sculean et al., 2000а и 2000b). В одном из контролируемых гистологических исследований на животных с помощью хирургического удаления щечной костной пластинки и цемента корня были созданы искусственные рецессии (Hammarström et al., 1997). В основной группе дефект устраняли, используя ЭМП, а в контрольной – методом коронально смещенного лоскута. Через 8 недель после вмешательства животных забивали и готовили гистологические срезы сегментов челюсти. В основной группе во всех образцах обнаружили пародонт (т.е. неклеточный цемент с вросшими в него коллагеновыми волокнами и альвеолярную кость). В контрольной группе обнаруживали протяженный участок прикрепленного эпителия и незначительный объем новообразованного цемента и кости. В контрольной группе цемент содержал больше клеток и был лишь частично прикреплен к поверхности корня. Интересно, что в основной группе не было выявлено ни одного случая резорбции корня, в то время как в контрольной группе такое осложнение встречалось довольно часто. Важно отметить, что в течение всего периода наблюдения гигиену полости рта не проводили. В двух более поздних исследованиях на обезьянах рецессии и внутрикостные дефекты также моделировали хирургически (Sculean et al., 2000а и 2000b). Дефекты устраняли следующими способами: 1) НТР; 2) ЭМП; 3) ЭПМ и НТР; 4) только лоскутная операция (контрольная группа). Гистологический анализ показал, что в контрольной группе происходило образование широкого эпителиального прикрепления, а регенерация пародонта была не выражена, в то же время в остальных группах удалось достичь регенерации пародонта.
Первые результаты гистологического исследования биоптатов человека опубликовал Heijl (1997). Рецессию в области нижнего резца создали хирургически, а затем устранили, используя ЭМП. Через 4 месяца зуб с прилежащими мягкими тканями и костью удалили и исследовали гистологически. Безклеточный цемент покрывал 73% глубины исходного дефекта. Об аналогичных результатах сообщили и другие авторы, причем не только при устранении рецессий, но и внутрикостных дефектов (Sculean et al., 1999b, 2000c; Mellonig, 1999; Rasperini et al., 2000; Yukna и Melonig, 2000) (рис. 4 и 5). Тем не менее, нехирургические методы лечения (т.е. закрытый кюретаж ручными и ультразвуковыми инструментами) в комбинации с ЭМП не улучшает регенерацию пародонта в области внутрикостных дефектов у людей (Sculean et al., 2003b). Контролируемые клинические исследования доказали, что при устранении внутрикостных дефектов с использованием ЭМП удается добиться значительного уменьшения глубины карманов при зондировании и увеличить уровень клинического прикрепления (Heijl et al.,1997; Pontoriero et al., 1999; Silvestri et al., 2000; Okuda et al., 2000; Froum et al., 2001; Sculean et al., 1999c, 2001b; Tonetti et al., 2002; Trombelli et al., 2002; Zuchelli et al., 2002). Эффективность ЭМП изучили в ходе рандомизированного, плацебо-конролируемого, многоцентрового исследовании, включавшем 33 пациента (Heijl et al., 1997). Через 36 месяцев уровень клинического прикрепления увеличился на 2,2 мм в исследуемой группе и на 1,7 мм в контрольной (открытый кюретаж). В исследуемой группе среднее увеличение уровня кости происходило на 2,6 мм, а заполнение дефекта костью составило 66%. В контрольной группе наращивания кости достичь не удалось. В другом контролируемом клиническом исследовании Froum и соавт. (2001) сравнили эффективность устранения внутрикостных дефектов с помощью лоскутной операции с использованием ЭМП (53 дефекта) и без них (31 дефект). Всего в исследовании участвовали 23 пациента с двумя внутрикостными дефектами, как минимум, у каждого. Эффективность устранения дефектов оценивали через 12 месяцев. При использовании ЭМП заполнение дефектов было в 3 раза больше, чем без них (74% в основной группе и 23% в контрольной). В проспективном контролируемом клиническом исследовании, включавшем 40 пациентов, сравнивали эффективность ЭМП или НТР (одна нерезорбируемая мембрана или две резорбируемых) и традиционной лоскутной операции (контрольная группа) (Pontoriero et al., 1999). Все 4 регенеративных методики показали одинаковую эффективность (уменьшение глубины при зондировании и увеличение уровня клинического прикрепления) и значительно превосходили лоскутные операции.
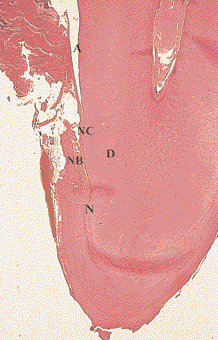
Рис. 4. Заживление внутрикостного дефекта человека после лечения с использованием эмалевых матричных протеинов. Заживление характеризуется формированием нового цемента (НЦ), новой пародонтальной связки (НПС) и новой кости (НК). Д – дентин, Н – насечка, А – артефакт (окраска гематоксилин-эозином, увеличение в 25 раз)
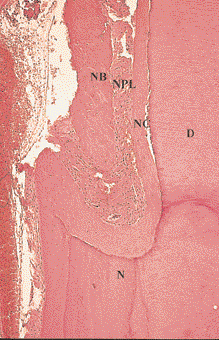
Рис. 5. Более сильное увеличение средней части дефекта, показанного на Рис. 4. Хорошо визуализируются сформированные новый цемент (НЦ), новая пародонтальная связка (НПС) и новая кость (НК). Н – насечка, Д – дентин (окраска гематоксилин-эозином, увеличение в 150 раз)
Tonetti и соавт. (2002) провели проспективное рандомизированное многоцентровое клиническое исследование для изучения эффективности устранения внутрикостных дефектов с помощью сохраняющей десневые сосочки методики и ЭМП. Всего устранили 83 дефекта в основной группе и 83 – в контрольной. Через год уровень клинического прикрепления был значительно больше в основной группе, чем в контрольной. В сравнительных исследованиях сообщается о сопоставимых результатах устранения внутрикостных дефектов с помощью ЭМП и НТР, причем оказалось, что тип мембраны (резорбируемая или нерезорбируемая) значения не имел (Sculean et al., 1999b, 1999c и 2001b; Pontoriero et al., 1999; Silvestri et al., 2000; Zuchelli et al., 2002). Sculean и соавт. (2001b) провели проспективное контролируемое клиническое исследование для оценки эффективности устранения внутрикостных дефектов с помощью различных методик: ЭМП, НТР, комбинация ЭМП и НТР, традиционная лоскутная операция. Результаты показали, что все три регенеративных методики обеспечили значительное улучшение клинических параметров по сравнению с лоскутной операцией. Лучшие результаты были получены при использовании комбинации ЭМП и НТР. Данные четырех- и пятилетних исследований позволяют предположить, что клинические результаты, полученные в результате применения ЭМП, имеют хороший долгосрочный прогноз (Sculean et al., 2001c, 2003c, 2004b).
Комбинированное лечение
Экспериментальные и клинические исследования показывают, что степень регенерации обусловлена объемом пространства под слизисто-надкостничным лоскутом (Wikesjö и Selvig, 1999; Gottlow et al., 1986; Karring et al., 1993; Selvig et al., 1993). Коллапс лоскута ведет к уменьшению пространства, в котором может происходить процесс регенерации, и, следовательно, сказывается на окончательном результате. Для предотвращения описанной проблемы было предложено несколько методик, которые заключались в комбинации различных материалов: заменители кости с клеточными пептидами; аутогенная костная стружка или заменители кости с НТР или PDGF; ЭМП с НТР; ЭМП с аутогенной костной стружкой (Camelo et al., 1998, 2003; Nevins et al., 2003a, 2003b; Sculean et al., 2000a, 2000b, 2001b, 2002b, 2002c, 2003a, 2003d, 2004a, 2004b, 2004c; Yukna et al., 2003). Результаты гистологических исследований доказывают регенерацию пародонта при использовании некоторых перечисленных методик для устранения внутрикостных дефектов (Camelo и соавт., 1998, 2003; Nevins и соавт., 2001, 2003a, 2003b; Sculean и соавт., 2000a, 2000b, 2003a, 2004a, 2004c; Yukna и соавт., 2003) (рис. 6-10). Однако, данные клинических исследований противоречивы и не позволяют сделать однозначных выводов о клинических преимуществах комбинированной терапии перед монотерапией (Schallhorn и McClain, 1988; Chen et al.,1995; Mellado et al., 1995; Gouldin et al., 1996; Kim et al., 1996; Kilic et al., 1997; Lecovic et al., 2000; Trejo et al., 2000; Yukna et al., 2000; Scheyer et al., 2002; Velasquez-Plata et al., 2002; Sculean et al., 2002b, 2002c; Stavropoulos et al., 2003).
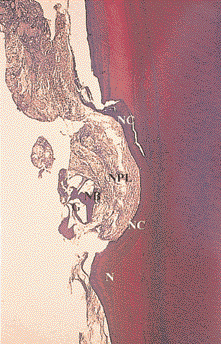
Рис. 6. Заживление внутрикостного дефекта человека после лечения с использованием комбинации эмалевых матричных протеинов и биологически активного стекла. Заживление характеризуется формированием нового цемента (НЦ) и новой пародонтальной связки (НПС). Частицы костного материала окружены новой костью (НК). Н – насечка (окраска соединительной ткани по Ладевигу, увеличение в 25 раз)
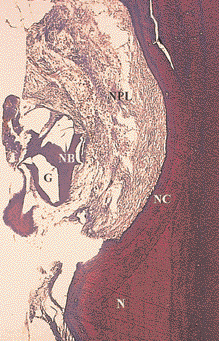
Рис. 7. Более сильное увеличение корональной части дефекта, показанного на Рис. 6. Очевидно образование нового цемента (НЦ) и новой пародонтальной связки (НПС). Частицы материала (М) окружены новой костью (НК). Н – насечка (окраска соединительной ткани по Ладевигу, увеличение в 150 раз)
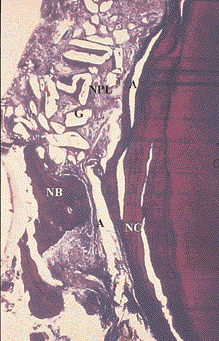
Рис. 8. Заживление внутрикостного дефекта человека после лечения с использованием комбинации эмалевых матричных протеинов и биологически активного стекла. В результате произошло формирование нового цемента (НЦ) и новой пародонтальной связки (НПС). Частицы костного материала окружены новой костью (НК) (окраска соединительной ткани по Ладевигу, увеличение в 25 раз)
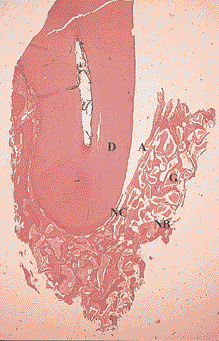
Рис. 9. Заживление внутрикостного дефекта человека после лечения с использованием комбинации бычьего костного минерала и коллагеновой мембраны. Заживление характеризуется формированием нового цемента (НЦ), новой пародонтальной связки (НПС) и новой кости (НК). Частицы костного материала окружены новой костью (НК). Д – дентин, А – артефакт (окраска гематоксилин-эозином, увеличение в 25 раз)
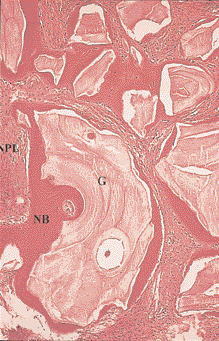
Рис. 10. Более сильное увеличение дефекта, показанного на Рис. 9. Частицы костного материала (М) окружены новой костью (НК). НПС – новая пародонтальная связка (окраска гематоксилин-эозином, увеличение в 250 раз
Заключение
Гистологические данные, полученные в ходе клинических исследований, показывают, что хирургическое лечение с использованием материалов для НТР, эмалевых матричных протеинов, факторов роста или комбинации перечисленных материалов позволяет достичь регенерации пародонта. Однако в настоящее время неизвестно, в какой степени комбинация НТР, эмалевых матричных протеинов, факторов роста и различных видов костных материалов позволяет получить дополнительные гистологические и клинические преимущества.
Литература
- Arweiler NB, Auschill TM, Donos N, Sculean A: Antibacterial effect of an enamel matrix protein derivative on in vivo dental biofilm vitality. Clin Oral Invest 2002; 6: 205–209.
- Blomlöf JPS, Blomlöf LB, Lindskog SF: Smear removal and collagen exposure after non-surgical root planing followed by etching with EDTA gel preparation. J Periodontol 1996a; 67: 841–845.
- Blomlöf J, Jansson L, Blomlöf L, Lindskog S: Etching at neutral pH promotes periodontal healing. J Clin Periodontol 1996b; 23: 50–55.
- Blomlöf L, Bergman E, Forsgardh A, Foss L, Larsson A, Sjöberg B, et al: A clinical study of root surface conditioning with an EDTA gel. I. Nonsurgical periodontal treatment. Int J Periodontics Restorative Dent 2000a; 20:561–565.
- Blomlöf L, Johnsson B, Blomlöf J, Lindskog S: A clinical study of root surface conditioning with an EDTA gel. II. Surgical periodontal treatment. Int J Periodontics Restorative Dent 2000b; 20: 567–573.
- Bogle G, Adams D, Crigger M, Klinge B, Egelberg J: New attachment after surgical treatment and acid conditioning of roots in naturally occurring periodontal disease in dogs. J Periodont Res 1981; 16: 130–133.
- Caffesse RG, Nasjleti EC, Morrison EC, Sanchez R: Guided tissue regeneration: Comparison of bioabsorbable and non-bioabsorbable membranes. Histologic and histometric study in dogs. J Periodontol 1994; 64: 583–591.
- Caffesse RG, Mota LF, Quinones CR, Morrison EC: Clinical comparison of resorbable and non-resorbable barriers for guided periodontal tissue regeneration. J Clin Periodontol 1997; 24: 747–752.
- Camelo M, Nevins M, Schenk R, Simion M, Rasperini G, Lynch S, et al: Clinical, radiographic, and histologic evaluation of human periodontal defects treated with Biooss‚ and Bio-Gide. Int J Periodont Rest Dent 1998; 18:321–331.
- Camelo M, Nevins ML, Schenk RK, Lynch SE, Nevins M: Periodontal regeneration in human Class II furcations using purified recombinant human platelet-derived growth factor (rhPDGF-BB) with bone allograft. Int J Periodont Rest Dent 2003; 23: 213–225.
- Chen CC, Wang HL, Smith F, Glickman GN, Shyr Y, O`Neal RB: Evaluation of a collagen membrane with and without bone grafts in treating periodontal intrabony defects. J Periodontol 1995; 66: 838–847.
- Christgau M, Schmalz G, Reich E, Wenzel A: Clinical and radiographical split-mouth study on resorbable versus non-resorbable GTR-membranes. J Clin Periodontol 1995; 22: 306–315.
- Cole RT, Crigger M, Bogle G, Egelberg J, Selvig KA: Connective tissue regeneration to periodontally diseased teeth. A histological study. J Periodont Res 1980; 15: 1–9.
- Cortellini P, Clauser P, Pini Prato GP: Histologic assessment of new attachment following the treatment of human buccal recession by means of guided tissue regeneration procedure. J Periodontol 1993; 64: 387–391.
- Cortellini P, Pini Prato GP, Tonetti MS: Periodontal regeneration of human intrabony defects with bioresorbable membranes. A controlled clinical trial. J Periodontol 1996;67: 217–223.
- Eickholz P, Lenhard M, Benn DK, Staehle HJ: Periodontal surgery of vertical bony defects with or without synthetic bioabsorbable barriers. 12-month results. J Periodontol 1998; 69: 1210–1217.
- Frank RM, Fiore-Donno G, Cimasoni G: Cementogenesis and soft tissue attachment after citric acid treatment in a human. An electron microscopic study. J Periodontol 1983; 54: 389–401.
- Froum SJ, Weinberg MA, Rosenberg E, Tarnow D: A comparative study utilizing open flap debridement with and without enamel matrix derivative in the treatment of periodontal intrabony defects: a 12-month re-entry study. J Periodontol 2001; 72: 25–34.
- Gestrelius S, Andersson C, Johansson AC, Persson E, Brodin A, Rydhag L, et al: Formulation of enamel matrix derivative surface coating. Kinetics and cell colonization. J Clin Periodontol 1997a; 24: 678–684.
- Gestrelius S, Andersson C, Lidström D, Hammarström L, Sommerman M: In vitro studies on periodontal ligament cells and enamel matrix derivative. J Clin Periodontol 1997b; 24: 685–692.
- Giannobile WV, Finkelman RD, Lynch SE: Comparison of canine and non-human primate animal models for periodontal regenerative therapy: results following a single administration of PDGF/IGF-I. J Periodontol 1994; 65:1158–1168.
- Giannobile WV, Hernandez RA, Finkelman RD, Ryan S, Kinitsy CP, D`Andrea M, et al: Comparative effects of platelet-derived growth factor-BB and insulin-like growth factor-I, individually and in combination, on periodontal regeneration in Macaca fascicularis. J Periodont Res 1996; 31: 301–312.
- Gottlow J, Nyman S, Karring T, Lindhe J: New attachment formation as a result of controlled tissue regeneration. J Clin Periodontol 1984; 11: 494–503.
- Gottlow J, Nyman S, Lindhe J, Karring T, Wennström J: New attachment formation in the human periodontium by guided tissue regeneration. Case reports. J Clin Periodontol 1986; 13: 604–616.
- Gottlow J, Laurell L, Lundgren D, Mathisen T, Nyman S, Rylander H: Periodontal tissue response to a new bioresorbable guided tisssue regeneration device: A longitudinal study in monkeys. Int J Periodont Rest Dent 1994;14: 437–449.
- Gouldin AG, Fayad S, Mellonig JT: Evaluation of guided tissue regeneration in interproximal defects. (II) Membrane and bone versus membrane alone. J Clin Periodontol 1996; 23: 485–491.
- Hammarström L: Enamel matrix, cementum development and regeneration. J Clin Periodontol 1997; 24: 658–668.
- Hammarström L, Heijl L, Gestrelius S: Periodontal regeneration in a buccal dehiscence model in monkeys after application of enamel matrix proteins. J Clin Periodontol 1997; 24: 669–677.
- Heijl L: Periodontal regeneration with enamel matrix derivative in one human experimental defect. A case report. J Clin Periodontol 1997; 24: 693–696.
- Heijl L, Heden G, Svardström G, Östgren A: Enamel matrix derivative (Emdogain‚) in the treatment of intrabony periodontal defects. J Clin Periodontol 1997; 24:705–714.
- Howell TH, Fiorellini JP, Paquette DW, Offenbacher S, Giannobile WV, Lynch S: A phase I/II clinical trial to evaluate a combination of recombinant human plateletderived growth factor-BB and recombinant human insulinlike growth factor-I in patients with periodontal disease. J Periodontol 1997; 68: 1186–1193.
- Hürzeler MB, Quinones CR, Caffesse RG, Schüpbach P, Morrison E: Guided periodontal tissue regeneration in interproximal defects following treatment with a synthetic bioabsorbable barrier. J Periodontol 1997; 68:489–497.
- Jepsen S, Terheyden H: Bone morphogenetic proteins in periodontal regeneration. In: Vukicevic S and Sampath KT (eds). Bone Morphogenetic Proteins. Basel: Birkhäuser Verlag 2002; 183–192.
- Karring T, Nyman S, Gottlow J, Laurell L: Development of the biological concept of guided tissue regeneration - animal and human studies. Periodontology 2000 1993; 1:26–35.
- Karring T, Lindhe J, Cortellini P: Regenerative periodontal therapy. In: Lindhe J, Karring T, Lang NP (eds). Clinical Periodontology and Implant Dentistry. Blackwell-Munksgaard 2003; 650–704.
- Kawase T, Okuda K, Yoshie H, Burns DM: Cytostatic action of enamel matrix derivative (EMDOGAIN‚) on human oral squamous cell carcinoma-derived SCC25 epithelial cells. J Periodont Res 2000; 35: 291– 300.
- Kilic AR, Efeoglu E, Ylmaz S: Guided tissue regeneration in conjunction with hydroxyapatite-collagen grafts for intrabony defects. A clinical and radiological evaluation. J Clin Periodontol 1997; 24: 372–383.
- Kim CK, Choi EJ, Cho KS, Chai JK, Wikesjö UM: Periodontal repair in intrabony defects treated with a calcium carbonate implant and guided tissue regeneration. J Periodontol 1996; 67: 1301–1306.
- Laurell L, Falk H, Fornell J, Johard G, Gottlow J: Clinical use of a bioresorbable matrix barrier in guided tissue regeneration therapy. Case series. J Periodontol 1994; 65:967–975.
- Lekovic V, Camargo PM, Weinlaender M, Nedic M, Aleksic Z, Kenney EB: A comparison between enamel matrix proteins used alone or in combination with bovine porous bone mineral in the treatment of intrabony periodontal defects in humans. J Periodontol 2000; 71:1110–1116.
- Lynch SE, Williams RC, Polson AM: A combination of platelet-derived and insulin-like growth factors enhances periodontal regeneration. J Clin Periodontol 1989; 16:545–548.
- Lynch SE, de Castilla GR, Williams RC, et al: The effects of short-term application of a combination of platelet-derived and insulin-like growth factors on periodontal wound healing. J Periodontol 1991; 62: 458–467.
- Lyngstadaas SP, Lundberg E, Ekdahl H, Andersson C, Gestrelius S: Autocrine growth factors in human periodontal ligament cells cultured on enamel matrix derivative. J Clin Periodontol 2001; 28: 181–188.
- Magnusson I, Claffey N, Bogle S, Garrett S, Egelberg J: Root resorption following periodontal flap procedures in monkeys. J Periodont Res 1985; 20: 79–85.
- Mellado JR; Salkin LM, Freedman AL, Stein MD: A comparative study of ePTFE periodontal membranes with and without decalcified freeze-dried bone allografts for the regeneration of interproximal intraosseous defects. J Periodontol 1995; 66: 751–755.
- Mellonig JT: Enamel matrix derivative for periodontal reconstructive surgery: technique and clinical and histologic case report. Int J Periodontics Restorative Dent 1999;19: 9–19.
- Moore JA, Ashley FP, Watermann CA: The effect on healing of the application of citric acid during replaced flap surgery. J Clin Periodontol 1987; 14: 130–135.
- Needleman I, Tucker R, Giedrys-Leeper E, Worthington H: A systematic review of guided tissue regeneration for periodontal infrabony defects. J Periodont Res 2002;37:380–388.
- Newman SE, Coscia SA, Jotwani R, Iacono VJ, Cutler CW: Effects of enamel matrix derivative on Porphyromonas gingivalis. J Periodontol 2003; 74: 1191–1195.
- Nevins ML, Camelo M, Lynch SE, Schenk RK, Nevins M: Evaluation of periodontal regeneration following grafting intrabony defects with Bio-Oss Collagen: a human histologic report. Int J Periodontics Restorative Dent 2003a;23: 9–17
- Nevins M, Camelo M, Nevins ML, Schenk RK, Lynch SE: Periodontal regeneration in humans using recombinant human platelet-derived growth factor-BB (rhPDGF-BB) and allogen bone. J Periodontol 2003b; 74:1282–1292.
- Nyman S, Lindhe J, Karring T, Rylander H: New attachment following surgical treatment of human periodontal disease. J Clin Periodontol 1982; 9: 290–296.
- Okuda K, Momose M, Miyazaki A, Murata M, Yokohama S, Yonezawa Y, et al: Enamel matrix derivative in the treatment of human intrabony osseous defects. J Periodontol 2000; 71: 1821–1828.
- Pontoriero R, Nyman S, Ericsson I, Lindhe J: Guided tissue regeneration in surgically-produced furcation defects. J Clin Periodontol 1992; 19: 159–163.
- Pontoriero R, Wennström J, Lindhe J: The use of barrier membranes and enamel matrix proteins in the treatment of angular bone defects. A prospective controlled clinical study. J Clin Periodontol 1999; 26: 833–840.
- Rasperini G, Silvestri M, Schenk RK, Nevins ML: Clinical and histological evaluation of human gingival recession treated with a subepithelial connective tissue graft and enamel matrix derivative (Emdogain): a case report. Int J Periodontics Restorative Dent 2000; 20: 269–275.
- Ripamonti U, Heliotis M, van der Heerer B, Reddi AH: Bone morphogenetic proteins induce periodontal regeneration in the baboon (papio ursinus). J Periodont Res 1994; 29:439–445.
- Rutherford RB, Niekrash CE, Kennedy JE, Charette MF: Platelet-derived and insulin-like growth factors stimulate regeneration of periodontal attachment in monkeys. J Periodont Res 1992; 27: 285–290.
- Schallhorn RG, McClain PK: Combined osseous composite grafting, root conditioning, and guided tissue regeneration. Int J Periodont Rest Dent 1988; 8: 9–31.
- Scheyer ET, Velasquez-Plata D, Brunsvold MA, Lasho DJ, Mellonig JT: A clinical comparison of a bovine-derived xenograft used alone and in combination with enamel matrix derivative for the treatment of periodontal osseous defects in humans. J Periodontol 2002; 73: 423–432.
- Sculean A, Donos N, Chiantella GC, Windisch P, Reich E, Brecx M: Treatment of intrabony defects with bioabsorbable membranes. A clinical and histologic study. Int J Periodontics Restorative Dent 1999a; 19: 501–509.
- Sculean A, Donos N, Windisch P, Gera I, Brecx M, Reich E, Karring T: Healing of human intrabony defects following treatment with enamel matrix proteins or guided tissue regeneration. J Periodont Res 1999b; 34:310–322.
- Sculean A, Donos N, Blaes A, Lauermann M, Reich E, Brecx M: Comparison of enamel matrix proteins and bioabsorbable membranes in the treatment of intrabony periodontal defects. A split-mouth study. J Periodontol 1999c; 70: 255–262.
- Sculean A, Donos N, Reich E, Brecx M, Karring T: Healing of recession-type defects following treatment with enamel matrix proteins or guided tissue regeneration. A pilot study in monkeys. J Parodontol Implant Orale 2000a;19: 19–31.
- Sculean A, Donos N, Brecx M, Reich E, Karring T: Treatment of intrabony defects with enamel matrix proteins and guided tissue regeneration. An experimental study in monkeys. J Clin Periodontol 2000b; 27: 466–472.
- Sculean A, Chiantella GC, Windisch P, Donos N: Clinical and histologic evaluation of treatment of intrabony defects with an enamel matrix protein derivative (Emdogain‚). Int J Periodont Rest Dent 2000c; 20:375–381.
- Sculean A, Auschill TM, Donos N, Brecx M, Arweiler N: Effect of an enamel matrix derivative (Emdogain‚) on ex vivo dental plaque vitality. J Clin Periodontol 2001a;28: 1074–1078.
- Sculean A, Windisch P, Chiantella GC, Donos N, Brecx M, Reich E: Treatment of intrabony defects with enamel matrix proteins and guided tissue regeneration. A prospective controlled clinical study. J Clin Periodontol 2001b;28: 397–403.
- Sculean A, Donos N, Miliauskaite A, Arweiler N, Brecx M: Treatment of intrabony defects with enamel matrix proteins or bioresorbable membranes. A four-year follow-up split-mouth study. J Periodontol 2001c; 72:1695–1701.
- Sculean A, Windisch P, Keglevich T, Fabi B, Lundgren E, Lyngstadaas PS: Presence of an enamel matrix protein derivative on human teeth following periodontal surgery. Clin Oral Invest 2002a; 6: 183–187.
- Sculean A, Barbé G, Chiantella GC, Arweiler NB, Berakdar M, Brecx M: Clinical evaluation of an enamel matrix protein derivative combined with a bioactive glass for the treatment of intrabony periodontal defects in humans. J Periodontol 2002b; 73: 401–408.
- Sculean A, Chiantella GC, Windisch P, Gera I, Reich E: Clinical evaluation of an enamel matrix protein derivative (Emdogain‚) combined with a bovine derived xenograft (Bio-Oss‚) for the treatment of intrabony periodontal defects in humans. Int J Periodont Rest Dent 2002c; 22:259–267.
- Sculean A, Windisch P, Keglevich T, Chiantella GC, Gera I, Donos N: Clinical and histologic evaluation of human intrabony defects treated with an enamel matrix protein derivative combined with a bovine-derived xenograft. Int J Periodont Rest Dent 2003a; 23: 47–55.
- Sculean A, Windisch P, Keglevich T, Gera I: Histologic evaluation of human intrabony defects following non-surgical periodontal therapy with and without application of an enamel matrix protein derivative. J Periodontol 2003b;74: 153–160.
- Sculean A, Chiantella GC, Miliauskaite A, Brecx M, Arweiler NB: Four-year results following treatment of intrabony periodontal defects with an enamel matrix protein derivative. A report of 46 cases. Int J Periodont Rest Dent 2003c; 23: 345–351.
- Sculean A, Berakdar M, Chiantella GC, Donos N, Arweiler NB, Brecx M: Healing of intrabony defects following treatment with a bovine derived xenograft and collagen membrane. A controlled clinical study. J Clin Periodontol 2003d; 30: 73–80.
- Sculean A, Windisch P, Keglevich T, Gera I: Clinical and histological evaluation of an enamel matrix protein derivative combined with a bioactive glass for the treatment of intrabony periodontal defects in humans. Int J Periodont Rest Dent 2004a (in press).
- Sculean A, Donos N, Schwarz F, Becker J, Brecx M, Arweiler NB: Five year results following treatment of intrabony defects with enamel matrix proteins and guided tissue regeneration. J Clin Periodontol 2004b (in press).
- Sculean A, Stavropoulos A, Windisch P, Keglevich T, Karring T, Gera I: Healing of human intrabony defects following regenerative periodontal therapy with a bovine derived xenograft and guided tissue regeneration. Clin Oral Invest 2004c (in press).
- Selvig K, Kersten B, Wikesjö U: Surgical treatment of intrabony periodontal defects using expanded polytetrafluoroethylene barrier membranes: influence of defect configuration on healing response. J Periodontol 1993; 63:974–978.
- Sigurdsson TJ, Lee MB, Kubota K, Turek TJ, Wozney JM, Wikesjö UME: Periodontal repair in dogs: Recombinant human bone morphogenetic protein-2 significantly enhances periodontal regeneration. J Periodontol 1995;66: 131–138.
- Silvestri M, Ricci G, Rasperini G, Sartors S, Cattaneo V: Comparison of treatments of intrabony defects with enamel matrix derivative, guided tissue regeneration with a nonresorbable membrane and Widman modified flap. A pilot study. J Clin Periodontol 2000; 27: 603–610.
- Spahr A, Lyngstadaas SP, Boeckh C, Andersson C, Podbielski A, Haller B: Effect of the enamel matrix derivative Emdogain‚ on the growth of periodontal pathogens in vitro. J Clin Periodontol 2001; 29: 62–72.
- Stahl S, Slavkin HC, Yamada L, Levine S: Speculations about gingival repair. J Periodontol 1971; 43: 395–402.
- Stahl S, Froum S: Human suprabony healing responses following root demineralization and coronal flap anchorage. Histologic responses in seven sites. J Clin Periodontol 1991; 18: 685–689.
- Stavropoulos A, Karring ES, Kostopoulos L, Karring T: Deproteinized bovine bone and gentamicin as an adjunct to GTR in the treatment of intrabony defects: a randomized controlled clinical study. J Clin Periodontol 2003; 30: 486–495.
- Terranova V, Wikesjö UME: Extracellular matrices and polypeptide growth factors as mediators of functions of cells of the periodontium. J Periodontol 1987; 58:371–380.
- Tonetti MS, Lang NP, Cortellini P, Suvan JE, Adriaens P, Dubravec D, et al: Enamel matrix proteins in the regenerative therapy of deep intrabony defects. A multicentre randomized controlled clinical trial. J Clin Periodontol 2002; 29: 317–325.
- Trejo PM, Weltman R, Caffesse R: Treatment of intraosseous defects with bioabsorbable barriers alone or in combination with decalcified freeze-dried bone allograft: a randomized clinical trial. J Periodontol 2000; 71:1852–1861.
- Trombelli L, Heitz-Mayfield LJA, Needleman I, Moles D, Scabbia A: A systematic review of graft materials and biological agents for periodontal intraosseous defects. J Clin Periodontol 2002; 29: 117–135.
- Wikesjö UME, Selvig KA: Periodontal wound healing and regeneration. Periodontology 2000 1999; 19: 21–39.
- Wozney JM, Rosen VB, Celeste AJ, Mitsock LM, Whitters MJ, Kriz RW, et al: Novel regulators of bone formation: molecular clones and activities. Science 1988; 243:1528–1534.
- Van der Pauw MT, Van den Bos T, Everts V, Beertsen W: Enamel matrix-derived protein stimulates attachment of periodontal ligament fibroblast and enhances alkaline phosphatase activity and transforming growth factor b1 release of periodontal ligament and gingival fibroblasts. J Periodontol 2000; 71: 31–43.
- Velasquez-Plata D, Scheyer ET, Mellonig JT: Clinical comparison of an enamel matrix derivative used alone or in combination with a bovine-derived xenograft for the treatment of periodontal osseous defects in humans. J Periodontol 2002; 73: 433–440.
- Yukna R A, Mellonig J: Histologic evaluation of periodontal healing in humans following regenerative therapy with enamel matrix derivative. A 10-case series. J Periodontol 2000; 71: 752–759.
- Yukna RA, Krauser JT, Cailan DP, Evans GH, Cruz R, Martin M: Multicenter clinical comparison of combination anorganic bovine-derived hydroxyapatite matrix (ABM)/cell binding peptide (P-15) and ABM in human periodontal osseous defects. 6-month results. J Periodontol 2000;71: 1671–1679.
- Yukna RA, Salinas TJ, Carr RF: Periodontal regeneration following use of ABM/P-15: a case report. Int J Periodont Rest Dent 2003; 22: 146–155.
- Zuchelli G, Bernardi F, Montebugnoli L, De Sanctis M: Enamel matrix proteins and guided tissue regeneration with titanium-reinforced expanded polytetrafluoroethylene membranes in the treatment of intrabony defects: a comparative controlled clinical trial. J Periodontol 2002; 73:3–12.