Биоматериалы для реконструктивного лечения внутрикостных пародонтальных дефектов. Часть I: костные материалы и заменители кости
DMD, MS, PhD
Профессор, пародонтологическая клиника Бернского университета (Берн, Швейцария).
DMD, MS, PhD
Секция пародонтологии отделения консервативной стоматологии и пародонтологии университета Йогана Гуттенберга (Майнц, Германия).
© Издательство «Индекс Медиа», 2004–2025. Все права защищены. Любое использование материалов или их фрагментов допускается только с письменного разрешения ООО «Индекс Медиа».
Регенерацией называют репродукцию или реконструкцию утраченной или поврежденной ткани с восстановлением формы и функции (Wikesjö и Selvig, 1999; Caton и Greenstein, 1993; Machtei, 1997; World Workshop in Periodontology, 1996). Цель регенеративного пародонтологического лечения заключается в предсказуемом восстановлении поддерживающего аппарата зуба, утраченного в результате пародонтита или травмы. Гистологически, такое лечение должно приводить к формированию нового цемента корня с прикрепленными к нему коллагеновыми волокнами, новой пародонтальной связки и новой альвеолярной кости (Wikesjö и Selvig, 1999; Caton и Greenstein, 1993; Machtei, 1997; World Workshop in Periodontology, 1996). Нехирургическое итрадиционное хирургическое пародонтологическое лечение обычно приводит к успешному клиническому результату, характеризующемуся уменьшением глубины пародонтальных карманов при зондировании и увеличению клинического прикрепления. Однако гистологически такие виды терапии характеризуются формированием длинного прикрепленного эпителия вдоль обработанной поверхности корня без формирования цемента и пародонтальной связки (Caton и Greenstein, 1993). Несмотря на то, что в некоторых случаях традиционное пародонтологическое лечение приводит к росту кости, гистологические исследования ясно показывают, что между поверхностью корня и вновь сформированной костью образуется эпителиальная выстилка (Caton и Greenstein, 1993). Известно, что только гистологическое исследование позволяет предоставить объективные доказательства регенерации пародонта (Caton и Greenstein, 1993; World Workshop in Periodontology, 1996). В течение нескольких последних десятилетий был предложен целый ряд методов лечения, направленных на достижение регенерации пародонта. В целом, эти методы представляли собой различные типы хирургических вмешательств, включающих протравливание поверхности корня, имплантацию различных видов костных материалов, направленную тканевую регенерацию (НТР), использование эмалевых матричных протеинов и факторов роста. В настоящее время специалисты соглашаются в том, что для доказательства регенерации пародонта в результате проведения какой-либо манипуляции необходимо соблюдение ряда критериев (World Workshop in Periodontology, 1996):
- Гистологические данные, полученные в ходе контролируемых испытаний на животных, демонстрируют формирование нового цемента, новой пародонтальной связки и новой альвеолярной кости.
- Контролируемые клинические исследования показывают увеличение уровня клинического прикрепления (УК) и альвеолярной кости.
- Гистологические данные, полученные в ходе клинических исследований, показывают формирование нового цемента, новой пародонтальной связки и новой альвеолярной кости на поверхности корня, пораженной налетом.
Ниже представлен обзор материалов, используемых при проведении регенеративного пародонтологического лечения внутрикостных дефектов, причем особенное внимание уделяется наличию гистологических доказательств, полученных в ходе клинических исследований.
КОСТНЫЕ МАТЕРИАЛЫ / ЗАМЕНИТЕЛИ КОСТИ
Использование костных материалов или заменителей кости основывается на предположении о том, что такие материалы могут приводить к формированию новой кости, новой пародонтальной связки и цемента корня посредством одного из следующих механизмов:
- Остеогенез (если материал содержит образующие кость клетки).
- Остеокондукция (материал служит каркасом для формирующейся кости).
- Остеоиндукция (материал содержит вещества, индуцирующие рост кости).
Все виды костных материалов и заменителей кости можно распределить на следующие группы:
- Аутогенные трансплантаты — материалы, которые пересаживают из одной части тела в другую в пределах одного индивида. Такие трансплантаты могут быть получены из внеротовых (например, гребень подвздошной кости) и внутриротовых (например, бугры верхней челюсти или ретромолярная область нижней челюсти) источников.
- Аллогенные имплантаты (аллоимплантаты) — материалы, которые пересаживают в пределах одного вида от одного генетически отличного индивида другому.
- Ксеногенные имплантаты (ксеноимплантаты) — материалы, полученные от особей другого вида.
- Аллопластические материалы - синтетические или неорганические материалы, которые могут быть использованы в качестве заменителей кости.
Аутогенные трансплантаты
Аутогенные трансплантаты могут содержать некоторое количество жизнеспособных клеток, способных влиять на заживление кости посредством остеогенеза и (или) остекондукции. Такие материалы постепенно резорбируются И замещаются новой жизнеспособной костью.
Внутриротовые
Трансплантаты могут быть получены в области участков адентии, бугров верхней челюсти, в ретромолярной области нижней челюсти или из подбородка. Гистологическая оценка биоптатов человека показала формирование цемента корня, пародонтальной связки и альвеолярной кости после аутогенной трансплантации из внутриротовых источников (Ross и Cohen, 1968; Nabers et al, 1972; Hiatt et al, 1978; Stahl et al, 1983). В других исследованиях было показано формирование длинного прикрепленного эпителия вдоль санированной поверхности корня (Froum et al, 1983; Hawley и Miller, 1975; Listgarten and Rosenberg, 1979). Результаты контролируемых клинических исследований довольно противоречивы. Одни исследования показывают более высокие показатели увеличения клинического прикрепления и уменьшение дефекта после лечения, направленного на его устранение с помощью лоскутных различий между двумя процедурами (Moskow et al, 1979; Rivault et al, 1971; Froum et al, 1976; Carraro et al, 1976; Ellegaard and Löe, 1971). Данные, опубликованные в литературе, показывают, что применение аутогенных трансплантатов из внутриротовых источников может привести к регенерации пародонта.
Внеротовые
Аутогенный материал из гребня подвздошной кости использовали для устранения внутрикостных дефектов и дефектов в области бифуркации достаточно давно (Renvert et al, 1985; Schallhorn, 1968; Patur, 1974; Froum et al, 1975; Elegaard et al, 1974; Dragoo и Sullivan, 1973a, 1973b). Гистологические исследования биоптатов животных (обезьян) и человека показали формирование нового цемента, пародонтальной связки и альвеолярной кости в результате проведения лоскутных операций и заполнения внутрикостных дефектов аутогенным костным трансплантатом, полученным из гребня подвздошной кости (Renvert et al, 1985; Schallhorn, 1968; Patur, 1974; Froum et al, 1975; Elegaard et al, 1974; Dragoo и Sullivan, 1973a, 1973b). Dragoo и Sullivan (1973a, 1973b) продемонстрировали регенерацию пародонта через 8 месяцев после проведения указанного лечения не только в области внутрикостных дефектов, но и на 2 мм корональнее гребня кости. Однако при использовании аутогенного трансплантата из гребня подвздошной кости была отмечена резорбция корня в 7 из 250 случаев применения данного материала. Ellegaard et al (1974) проанализировали заживление внутрикостных дефектов у обезьян после использования аутогенного трансплантата из гребня подвздошной кости. Гистологические данные указывают на то, что регенерация пародонта чаще возникала при использовании трансплантата, чем без него. Однако применение трансплантата часто ассоциировалось с анкилозом и резорбцией корня.
Несмотря на то, что аутогенные трансилантаты из гребня подвздошной кости позволяют добиться регенерации пародонта, такие материалы более не используют при проведении регенеративного пародонтологического лечения из-за высокой вероятности развития резорбции корня и дискомфорта пациента, связанного с получением трансплантата.
Аллогенные материалы
Аллогенные имплантаты (аллоимплантаты) были предложены для стимуляции формирования кости без дополнительного дискомфорта, ассоциированного с донорским участком. Применение аллоимплантатов связано с наличием минимального риска развития антигенной реакции и переноса инфекции. В регенеративной пародонтологии наиболее широко используют аллоимплантаты минерализованной лиофилизированной кости (АЛК) и аллоимплантаты деминерализованной (декальцифицированной) лиофилизированной кости (АДЛК).
АЛК представляет собой минерализованный костный имплантат, в процессе производства которого были удалены живые клетки, поэтому АЛК способствует регенерации посредством остеокондукции (Goldberg и Stevenson, 1987). Результаты клинических исследований показывают, что устранение внутрикостных дефектов с помощью комбинации АЛК и аутогенной кости позволяет получить предпочтительные результаты по сравнению с использованием только АЛК (Mellonig, 1991). С другой стороны, сравнительные исследования показывают, что АЛК позволяет получить результаты, сравнимые с применением АДЛК или гидроксиапатита (Rummelhart et al, 1989; Barnett et al, 1989). Однако в единственном контролируемом исследовании эффективности устранения внутрикостных дефектов с помощью лоскутных операций с АЛК и без него не было обнаружено отличий в увеличении уровня прикрепления и степени заполнения дефекта (Altiere et al, 1979). Более того, анализ гистологических данных показывает, что применение АЛК приводило к формированию длинного прикрепленного эпителия без регенерации пародонта (Dragoo и Kaldahl, 1983).
Результаты испытаний на животных продемонстрировали остеогенный потенциал аллоимплантата деминерализованной лиофилизированной кости в результате высвобождения костных морфогенетических протеинов (КМП), обладающих способностью индуцировать формирование кости (Urist и Strates, 1970; Mellonig et al, 1981). Контролируемые клинические исследования показали, что устранение внутрикостных дефектов с помощью лоскутных операций и АДЛК приводило кзначительно большему увеличению УКП и заполнению дефектов по сравнению с одним только лоскутными вмешательствами (Pearson et al, 1981; Meadows et al, 1993; Flemmig et al, 1998). В ходе рандомизированного контролируемого клинического исследования Flemmig et al (1998) изучали долгосрочную стабилизацию уровня альвеолярной кости после имплантации аутолизированной неантигенной аллогенной кости (АНАК). Каждому из 14 пациентов во внутрикостный дефект в области одного зуба имплантировали АНАК (исследуемая группа дефектов), в то время как в области второго зуба с внутрикостным дефектом проводили только модифицированную лоскутную операцию по Видману (МЛАтап) (контрольная группа дефектов). После завершения терапии всем пациентам проводили поддерживающее пародонтологическое лечение с интервалами от 3 до 6 месяцев. Клинические показатели оценивали перед операцией, через 6 месяцев и 3 года после вмешательства. Из 14 участвовавших в настоящем исследовании пациентов одиннадцати пациентам было проведено контрольное обследование через 6 месяцев после операции и восьми - через 3 года. В исследуемой группе дефектов через 6 месяцев увеличение уровня кости по сравнению с контрольной группой было значительно выше (2,2+0,5 мм и 1,2=0,5 мм, соответственно; р<0,05). Кроме того, в тестируемой группе было достигнуто более выраженное увеличение уровня прикрепления через 3 года по сравнению с контрольной группой (2,0+0,7 мм и 0,8=0,5 мм, соответственно; р<0,05). Данные указывают на то, что полученное увеличение уровня альвеолярного гребня после имплантации АНАК может сохраняться на протяжении, как минимум, трех лет при условии проведения поддерживающего пародонтологического лечения.
Контролируемые сравнительные исследования эффективности АДЛК и АЛК не показали различий между этими материалами с точки зрения увеличения УКП и степени заполнения дефекта (Rummelhart et al, 1989). Гистологические доказательства регенерации пародонта в результате применения АДЛК для устранения внутрикостных дефектов были предоставлены Bowers et al (1989a, 1989b). Однако эти данные не были подтверждены в исследованиях на животных (Sonis et al, 1985; Caplanis et al, 1998). Подобные противоречия можно объяснить различным регенеративным и остеогенным потенциалом (от очень высокого до минимального) коммерчески доступных аллоимплантатов разных производителей (Becker et al, 1994, 1995; Shigeyema et al, 1995; Schwartz et al, 1996; Garraway et al, 1998).
Ксеногенные имплантаты
Ксеногенные имплантаты (ксеноимплантаты) бычьего происхождения несколько лет назад предложили использовать при проведении регенеративного пародонтологического лечения. Гистологические исследования человеческого материала, полученного после клинического использования ксеноимплантатов для устранения внутрикостных дефектов, показали образование цемента корня, пародонтальной связки и альвеолярной кости Camelo et al, 1998; Sculean et al, 2003). Camelo et al (1998) провели лечение в области четырех глубоких внутрикостных дефектов с помощью ксеноимплантата бычьего происхождения. Два дефекта дополнительно перекрывали биорезорбируемой коллагеновой мембраной. Гистологический анализ через 6 и 8 месяцев показал регенерацию пародонта во всех четырех препаратах.
Аналогичные наблюдения после лечения, направленного на устранение внутрикостных дефектов с помощью ксеноимплантатов, были сделаны и другими авторами (Sculean et al, 2003). Через шесть месяцев после завершения лечения дефекта, локализованного на дистальной поверхности моляра нижней челюсти, гистологический материал, полученный в указанном участке, показал формирование нового клеточного цемента с вросшими в него коллагеновыми волокнами на поверхности корня, которая до лечения была покрыта бактериальным налетом.
Апикальное прорастание эпителия останавливалось на уровне наиболее корональной части нового сформированного цемента, а частицы ксеноимплантата были окружены костеподобной тканью. Относительно недавно полученные результаты гистологических исследований после применения минерального ксеноимплантата, комбинированного с коллагеном, для устранения внутрикостных дефектов у человека продемонстрировали регенерацию пародонта (Nevins et al, 2003). Для устранения двух внутрикостных дефектов, локализованных в области однокорневых зубов, была проведена лоскутная операция с заполнением дефектов комбинированным материалом (бычий минерал и коллаген). Клиническое обследование, проведенное через 9 месяцев после вмешательства, показало увеличение УКП на 5 и 9 мм. В обоих случаях в процессе заживления произошло формирование нового цемента, новой пародонтальной связки и новой альвеолярной кости. Контролируемые клинические исследования показывают, что устранение внутрикостных дефектов с помощью ксеноимплантата позволяет получить результаты, сопоставимые с использованием АДЛК (Richardson et al, 1999). Как бы то ни было, в настоящее время отсутствуют опубликованные данные контролируемых клинических исследований сравнительной эффективности устранения внутрикостных дефектов или дефектов в области бифуркации с помощью лоскутных операций в комбинации с ксеноимплантатами и без них.
Несколько десятилетий назад было предложено использовать коралловый карбонат кальция в качестве костного заменителя. В зависимости от способа обработки из естественного коралла можно получить нерезорбируемый пористый гидроксиапатит или резорбируемый карбонат кальция. Контролируемые клинические исследования показали более значительное уменьшение глубины карманов при зондировании (ГКЗ), увеличение УКП и заполнения дефектов при использовании костного заменителя, чем без него (Kenney et al, 1985; Yukna, 1994; Mora и Ouhayoun, 1995; Yukna и Yukna, 1998). Сравнительные исследования показывают, что применение АЛК, АДЛК или пористого гидроксиапатита кораллового происхождения позволяет получить сравнимые результаты (Barnett et al, 1989; Bowen et al, 1989). Более того, результаты контролируемого клинического исследования показывают большую эффективность материала кораллового происхождения по сравнению с АДЛК (Oreamuno et al, 1990). Однако, гистологические исследования животного и человеческого материала не показали регенерации пародонта при использовании материала на основе коралла. Заживление в основном характеризовалось формированием длинного прикрепленного эпителия и соединительнотканной инкапсуляции частиц материала (West и Brustein, 1985; Ettel et al, 1989; Carranza et al, 1987; Stahl и Froum, 1987).
Аллопластические материалы
Аллопластическими материалами называют синтетические, неорганические, биосовместимые и (или) биоактивные костные заменители, которые, как предполагается, способствуют заживлению костных дефектов посредством остеокондукции. В регенеративной пародонтологической терапии используют следующие аллопластические материалы: гидроксиапатит (ГА), бета-трикальций фосфат (ß-ТКФ), полимеры и биоактивное стекло.
Гидроксиапатит (ГА)
ГА бывает резорбируемым и нерезорбируемым. Гистологические исследования животного и человеческого материала показывают лишь ограниченное заживление внутрикостных дефектов при использовании ГА (Barney et al, 1986; Minabe et al, 1988; Wilson и Low, 1992; Froum et al, 1982; Moskow и Lubarr, 1983; Ganeles et al, 1986; Sapkos, 1986). Заживление в основном характеризуется формированием длинного прикрепленного эпителия, В то время как большинство частиц ГА инкапсулируется соединительной тканью. Образование новой кости происходило крайне редко и только в непосредственной близости к костным стенкам дефекта. Контролируемые клинические исслелования показали более выраженное уменьшение ГКЗ, увеличение УКП и заполнение дефекта при использовании ГА, чем без него (Meffert et al, 1985; Yukna et al, 1985, 1986; Galgut et al, 1992). Следует отметить, что в проведенном недавно систематическом обзоре были отмечены значительные различия между результатами, полученными в разных исследованиях (Trombelli et al, 2002).
Бета-трикальций фосфат (ß-TCP)
Имплантация бета-грикальций фосфата (ВТКФ) во внутрикостные дефекты приводит к значительному увеличению УКП и заполнению дефекта (Strub et al, 1979; Snyder et al, 1984; Baldock et al, 1985). Гистологические данные, полученные в ходе испытаний на животных и клинических исследований, показывают, что данный материал либо быстро резорбируется, либо инкапсулируется соединительной тканью (Barney et al, 1986; Levin et al, 1974; Bowers et al, 1986; Froum и Stahl, 1987; Stahl и Froum, 1986; Saffar et al, 1990). Использование ß-ТКФ не позволяет предсказуемо добиваться формирования нового цемента и новой пародонтальной связки, в то время как формирование новой кости происходит достаточно редко.
Полимеры
В настоящее время для устранения внутрикостных дефектов в качестве костных заменителей используют два типа полимеров:
- поли-метил-метакрилат (ПММА) и полигидроксилэтил-метакрилат (ПГЭМА), покрытые нерезорбируемым гидроксидом кальция. Такой материал называют НТR-полимером (hard tissue replacement graft — заместитель твердой ткани).
- резорбируемая полимолочная кислота (РТА).
Гистологические исследования не показывают регенерации пародонта после имплантации НТR-полимера в пародонтальные дефекты (Plotzke et al, 1993; Stahl et al, 1990; Froum, 1996). Во всех гистологических препаратах частицы НТR-полимера были инкапсулированы соединительной тканью без формирования цемента и пародонтальной связки. Редко обнаруживали образование кости. В ходе контролируемых клинических исследований не было обнаружено значительных отличий у уменьшении ГКЗ и увеличении УКП при использовании НТR-полимера или без него (Yukna, 1990; Shahmiri et al, 1992)/ Более того, результаты контролируемых клинических исследований показали худшие результаты уменьшения ГКЗ и увеличения УКП при применении НТR-полимера, чем без него (Meadows et al, 1993).
Таблица 1. Гистологические доказательства (частичной) регенерации пародонта при устранении внутрикостных дефектов и клинические результаты при сравнении с открытым кюретажем (ОК) по данным РКИ, мета-анализа и (или) систематических обзоров
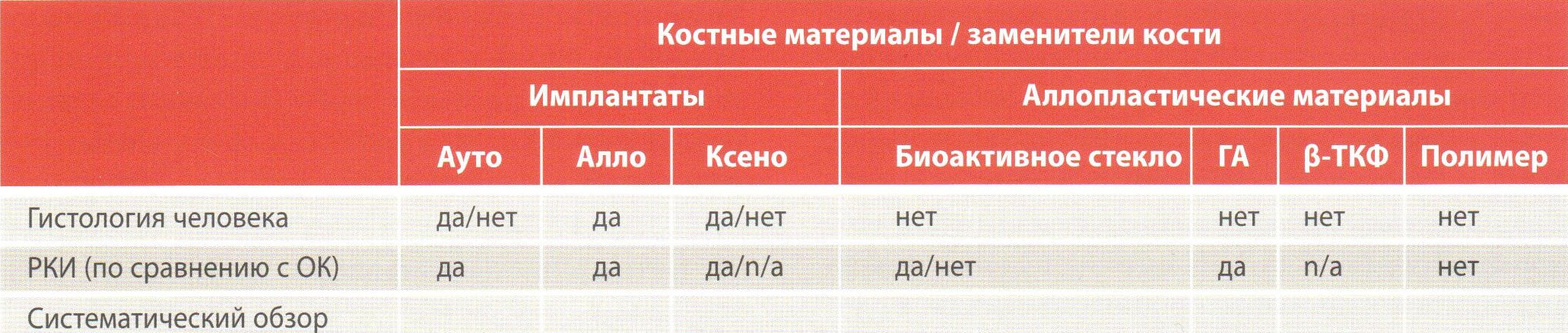
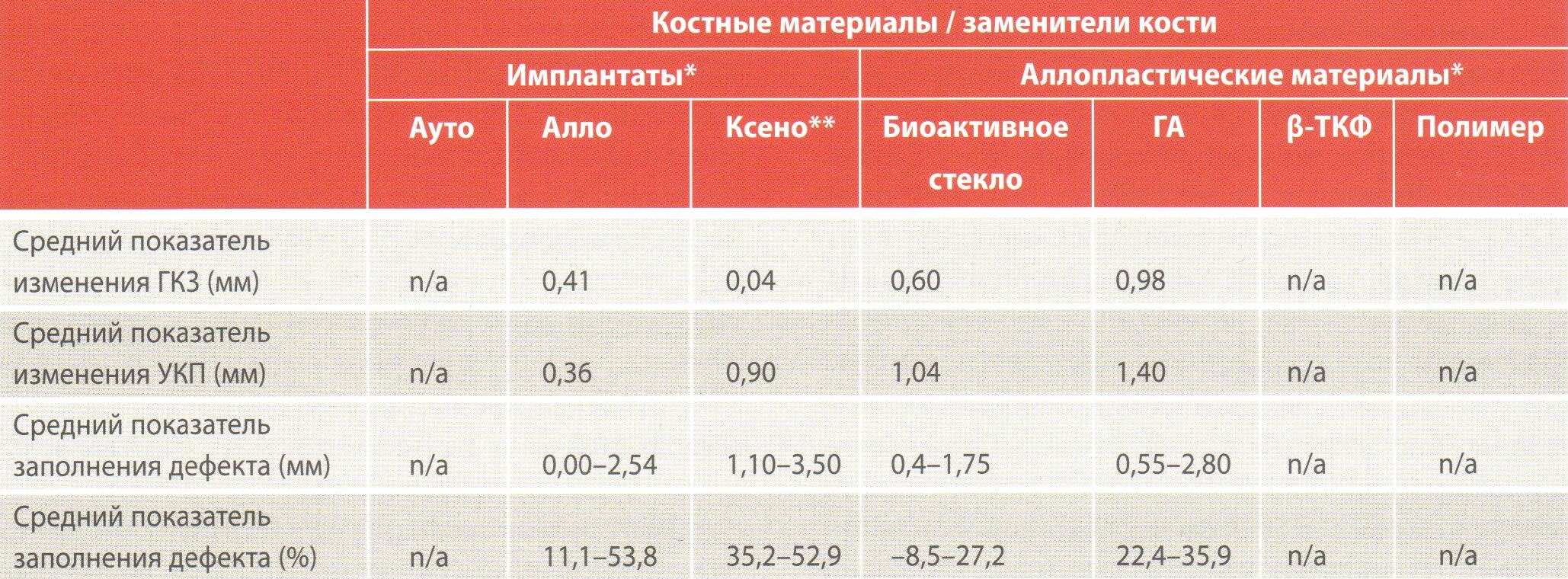
Таблица 2. Средние показатели ГКЗ, УКП и уровень заполнения дефекта исследуемых и контрольных (открытый кюретаж) групп дефектов по данным мета-анализа
Биологически активное стекло
Биологически активное стекло состоит из SiO2, Na2O и P2O5 и может быть резорбируемым или нерезорбируемым в зависимости от пропорции составляющих. При контакте биологически активного стекла с тканевой жидкостью на поверхности материала образуется двойной слой 1990; ЗБабтит еб а|, 1992). Более того, результаты контролируемых клинических исследований кремниевого геля и фосфата кальция. Считается, что такой слой способствует абсорбции и концентрации протеинов, используемых остеобластами для формирования внеклеточной костной матрицы, которая, в свою очередь, приводит к образованию кости. Гистологические данные, полученные в ходе испытаний на животных, показали, что биоактивное стекло обладает хорошими остеокондуктивными свойствами, подавляет апикальное прорастание эпителия и способствует формированию цемента корня, пародонтальной связки ческом случае, показали частичную регенерацию цемента, пародонтальной связки и кости после лечения, направленного на устранение внутрикостных дефектов с помощью биоактивного стекла (Rühling и Plagmann, 2001).
Однако, результаты двух других гистологических исследований человеческого материала, включающего восемь участков, не показали регенерации пародонта при использовании биоактивного стекла (Nevins et al, 2000; Sculean et al, 2004). После устранения внутрикостных дефектов с помощью биоактивного стекла Nevins et al (2000) отметили значительное уменьшение ГКЗ и увеличение УКП. Однако гистологически заживление характеризовалось формированием длинного прикрепленного прикрепления и соединительнотканной инкапсуляцией частиц материала. Лишь в одном из пяти биоптатов было отмечено незначительное образование нового цемента и пародонтальной связки. Аналогичные гистологические данные были получены в другом клиническом исследовании (Sculean et al, 2004). После имплантации биоактивного стекла в три глубоких внутрикостных дефекта гистологическое исследование показало лишь незначительную регенерацию пародонта только в области одного дефекта (Рис. 1—4).
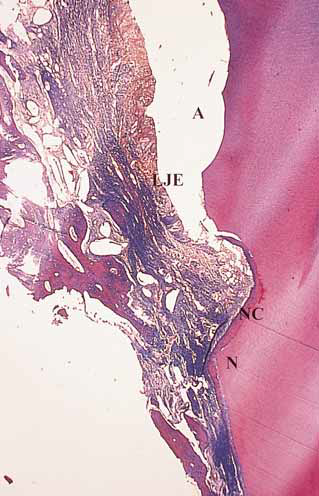
Рис. 1. Заживление внутрикостных дефектов человека после использования биоактивного стекла (С). Заживление характеризуется формированием длинного прикрепленного эпителия (ДПЭ) до корональной границы насечки (Н). Формирование нового цемента (НЦ) наблюдается только в области насечки. Частицы материала (С) инкапсулированы соединительной тканью. А — артефакт (окраска соединительной ткани по Ладевигу (Гаде\мо), увеличение в 25 раз)
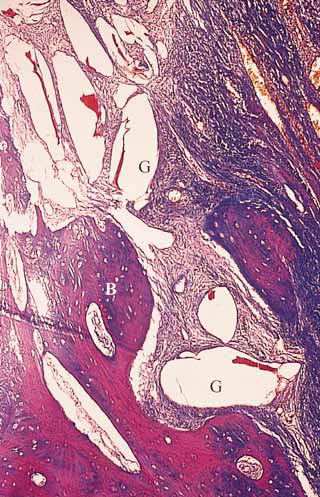
Рис. 2. Большее увеличение участка, изображенного на рис. 1. Частицы биоактивного стекла (С) инкапсулированы соединительной тканью (окраска соединительной ткани по Ладевигу, увеличение в 250 раз)
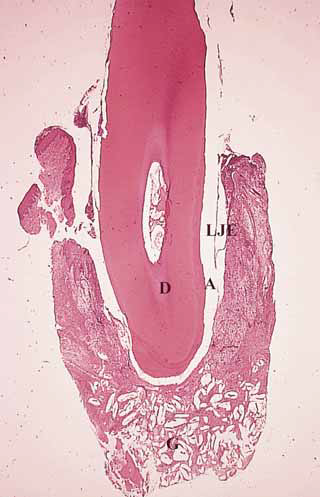
Рис. 3. Заживление внутрикостных дефектов человека после использования биоактивного стекла (С). Заживление характеризуется формированием длинного прикрепленного эпителия (ДПЭ) вдоль санированной поверхности корня. Частицы материала (С) инкапсулированы соединительной тканью. Д - дентин, А — артефакт (окраска гематоксилин-эозином, увеличение в 25 раз)
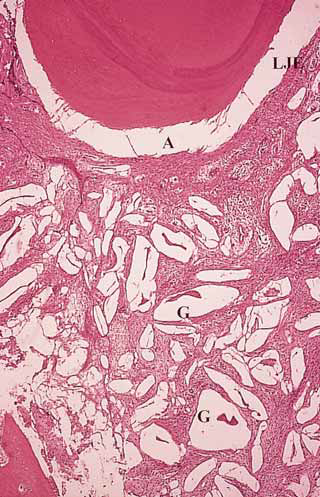
Рис. 4. Более сильное увеличение участка, изображенного на рис. 3. Частицы биоактивного стекла (С) инкапсулированы соединительной тканью. А - артефакт, ДПЭ - длинный прикрепленный эпителий (окраска гематоксилин-эозином, увеличение в 250 раз)
Материал обладает хорошими остеокондуктивными качествами, но не позволяет эффективно предотвращать апикальное прорастание эпителия. Контролируемое сравнительное клиническое исследование эффективности устранения внутрикостных дефектов посредством лоскутных манипуляций с биоактивным стеклом и без него показало более выраженное уменьшение ГКЗ и увеличение УКП при использовании биоактивного стекла, чем при проведении одной только лоскутной операции (Froum et al, 1998). Однако два других контролируемых клинических исследования не показали преимущества применения этого материала по сравнению с выполнением только лоскутного вмешательства (Zamet et al, 1997; Ong et al, 1998). С другой стороны, в одном из сравнительных клинических исследований были продемонстрированы одинаковые результаты при использовании биактивного стекла и АДЛК (Lovelance et al, 1998).
ЗАКЛЮЧЕНИЕ
Гистологические данные, полученные в ходе клинических бе тованон показывают, что применение аутогенной кости, деминерализованной лиофилизированной кости, ксеногенных дериватов бычьей кости позволяет добиться регенерации пародонта. В настоящее время отсутствуют тистологические доказательства возможности регенерации пародонта человека при использовании аллопластических (синтетических) материалов.
Список литературы
- Altiere E, Reeve C, Sheridan P: Lyophilized bone ailograft in periodontal osseous defects. J Periodontol 1979; 50:510-519.
- Baldock WT, Hutchens LH Jr, McFall WT Jr, Simpson DM: An evaluation of tricalcium phosphate implants in human periodontal defects. J Periodontol 1985; 56: 1-7.
- Barnett JD, Mellonig JT, Gray JL, Towle HJ: Comparison of freeze-dried bone allograft and porous hydroxyaparite in human periodontal defects. J Periodontol 1989; 60: 21-237.
- Barney VC, Levin MP, Adams DF: Bioceramical implants in surgical periodontal defects. A comparison study. J Periodontol 1986; 57: 764-770.
- Becker W, Becker BE, Caffesse R: A comparison of de-mineralized freeze-dried bone and autologous to induce bone formation in human extraction sockets. J Periodontol 1994; 65: 1128-1133.
- Becker W, Urist MR, Tucker LM, Becker BE, Ochsenbein C: Human demineralized freeze-dried bone: inadequate induced bone formation in athyrnic mice. A preliminary report. J Periodontol 1995; 66: 822-828.
- Bowen J, Mellonig J, Gray J; Towle H: Comparison of decalcified freeze-dried bone allograft and porous hydroxyapatite in human periodontal osseous defects. J Periodontol 1989; 60: 647-544.
- Bowers GM, Vargo, JW, Lerg B, Emerson JR, Bergquist JJ: Histologic observations following the placement of tricalcium phosphate implants in human intrabony defects. J Periodontol 1986; 57; 286-287.
- Bowers GM, Chadroff B, Carnevale R, Mellonig J, Corio R, Emerson JR, Stevens M, Romberg E: Histologic eva uation of new attachment apparatus formation in humans, Part II. J Periodontol 1989a; 60: 675-682.
- Bowers GM, Chadroff B, Carnevale R, Mellonig J, Corio R, Emerson J, Stevens M, Romberg E: Histoldgic evaluation ofa new attachment apparatus formation in humans. Part III. J Periodontol 1989b; 60: 683-693.
- Сamelo M, Nevins M, Schenk R, Simion M, Rasperini G, Lynch S, Nevins M: Clinical, radiographic, and histologic evaluation of human periodontal defects treated with Bio-Oss° and Bio-Gide. Int J Periodont Rest Dent 1998;18:321-331.
- Caplanis N, Lee MB, Zimmerman Gj, Selvig KA, Wikesjo UM: Effect of allogeneic freeze-dried demineralized bone matrix on regeneration of alveolar bone and periodontal attachment in dogs. J Clin Periodontol 1998; 25:801-806.
- Carranza FA, Kenney EB, Lekovic V, Taiamante E, Valencia J, Dimitrijevic B: Histologic study of healing of human periodontal defects after placement of porous hydroxylapatite implants. J Periodontol 1987; 58: 682-688.
- Carraro JJ, Sznajder N, Alonso CA: Intraoral cancellous bone autografts in the treatment of infrabony pockets. J Clin Periodontol 1976; 3: 104-109.
- Caton JG, Greenstein G. Factors related to periodontal regeneration: Periodontology 2000 1993; 1: 9-15.
- Dragoo MR, Sullivan HC: A clinical and histological evaluation of autogenous iliac bone grafts in humans. I. Wound healing 2 to 8 months. J Periodontol 1973a; 45:599-613.
- Dragoo MR, Sullivan HC: A clinical and histological evaluation of autogenous iliac bone grafts in humans. II. External root resorption. J Periodontol 1973b; 45: 614-625.
- Dragoo MR, Kaldahl WB: Clinical and histological evaluation of alloplasts and allografts in regenerative periodontal surgery in humans. Int J Periodont Rest Dent 1983; 3: 8-29.
- Ellegaard B, Loe H: New attachment of periodontal tissues after treatment of intrabony lesions. J Periodontol 1971; 42: 648-652.
- Ellegaard B, Karring T, Davies R, Loe H: New attachment after treatment of intrabony defects in monkeys. J Periodontol 1974; 45: 368-377.
- Ettel RG, Schaffer EM, Holpuch RC, Brandt CL: Porous hydroxyapatite grafts in chronic subcrestal periodontal defects in rhesus monkeys: a histological investigation. J Periodontol 1989; 60: 342-351.
- Flemmig TF, Ehmke B, Bob K, Kubler NR, Karch H, Reuther JE, Klaiber B: Long-term maintenance of alveolar bone gain after implantation of autolyzed, antigenextracted, allogenic bone in periodontal intraosseous defects. J Periodontol 1998; 69: 47-53.
- Froum SJ, Thaler R, Scopp IW, Stahl SS: Osseous autografts. I. Clinical responses to bone blend or hip marrow grafts, J Periodontol 1975; 46: 515-521.
- Froum SJ, Ortiz M, Witkin RT, Thaler R, Scopp IW, Stahl SS: Osseous autografts. III. Comparison of osseous coagulum-bone blend implant with open cureftage. J Periodontol 1976; 47: 287-294.
- Froum SJ, Kushnek L, Scopp IW, Stahl SS: Human clinical and histologic responses to durapatite in intraosseous lesions. Case reports. J Periodontol 1982;53:719-729.
- Froum SJ, Kushnek L, Scopp IW, Stahl SS: Healing responses of human intraosseous lesions following the use of debridement, grafting and citric acid root treatment. I. Clinical and histologic observations six months post-surgery. J Periodontol 1983;54:67-76.
- Froum §, Stahl SS: Human intraosseous healing response to the placement of tricalcium phosphate ceramic implants. II. 13 to 18 months. J Periodontol 1987558:103-109.
- Froum S: Human histologic evaluation of HTR polymer and freeze-dried bone allografts. A case report. J Clin Periodontol 1996;23:615-620.
- Froum SJ, Weinberg MA, Tarnow D: Comparison of bioactive glass synthetic bone graft particles in the treatment of human periodontal defects. A clinical study. J Periodontol 1998;69:698-709.
- Galgut PN, Waite IM, Brookshaw JD, Kingston CP: A 4-year controlled clinical study into the use of a ceramic hydroxyapatite implant material for the treatment of periodontal bone defects. J Clin Periodontol 1992;19: 570-577.
- Ganeles J, Listgarten MA, Evian Cl: Ultrastructure of durapatite periodontal tissue interface in human intrabony defects. J Periodontol 1986;57:133-140.
- Garraway R, Young WG, Daley T, Harbrow D, Bartold PM: An assessment of the osteoinductive potential of сommercial demineralized freeze-dried bone in the murine thigh muscle implantation model. J Periodontol 1998; 69:1325-1336.
- Goldberg VM, Stevenson S: The natural history of autografts and allografts. Clin Orthop 1987; 7-16.
- Hawley CE, Miller J: A histologic examination of a free osseous autograft. J Periodontol 1975;46:289-293.
- Hiatt WH, Schallhorn RG, Aaronian AJ: The induction of new bone and cementum formation, IV. Microscopic examination of the periodontium following human bone and marrow allograft, autograft and non-grafted periodontal regenerative procedures. J Periodontol 1978; 49:495-512.
- Karaizas S, Zavras A, Greenspan D, Arnar S; Histologic observations of periodontal wound healing after treatment with PerioGlas in nonhuman primates. Int J Periodont Rest Dent 1999; 19: 489-499.
- Kenney EB, Lekovic V, Han T, Carranza FA, Demitrijevic B: The use of porous hydroxylapatite implant in periodontal defects. I, Clinical results after six months, J Periodontol 1985;56:82-88.
- Levin MP, Getter L, Adrian J, Cutright DE: Healing 9 of periodontal defects with ceramic implants, J Cf, Periodontol 1974;1:197-205.
- Listgarten MA, Rosenberg MM: Histological study of repair following new attachment procedures in human periodontal lesions. J Periodontol 1979.59.333-344.
- LovelanceTB, Melionig JT, Meffert RM, Jones AA, Numikosky PV, Cochran DL: Clinical evaluation of bioactive glass in the treatment of periodontal defects in humans. J Periodontol 1998; 69: 1027-1035.
- Machtei E: Outcome variables in the study of periodontal regeneration. Ann Periodontol 1997;2:229-239.
- Meadows CL, Gher ME, Quintero G, Lafferty TA: A comparison of polylactic acid granules and decalcified freeze-dried bone allograft in human periodontal osseous defects. J Periodontol 1993;64:103-109.
- Meffert RM, Thomas JR, Hamilton KM, Browstein CR: Hydroxylapatite as an alloplastic graft in the treatment of human periodontal osseous defects. J Periodontol 1985;56; 63-73.
- Meilonig, JT, Bowers G, Bully: Comparison of bone graft materials. L New bone formation with autografts and allografts determined by strontium-85. J Periodontol 1981; 52: 291-296.
- Meilonig JT: Freeze-dried bone allografts in periodontal reconstructive surgery. Dent Clin North Am 1991; 35:505-520.
- Minabe M, Sugaya A, Satou H, Tamara T, Ogawa Y, Huri T, Watanabe Y: Histologic study of the hydroxyapatite-collagen complex implants in periodontal osseous defects in dogs. J Periodontol 1988;59:671-678.
- Mora F, Ouhayoun JP: Clinical evaluation of natural coral and porous hydroxyapatite implants in periodontal bone lesions: results of a 1-year follow-up. J Ciin Periodontol 1995;22:877-884.
- Moskow BS, Karsh F, Stein SD: Histological assessment of autogenous bone graft. A case report and critical evaluation. J Clin Periodontol 1979;6:291-300.
- Moskow BS, Lubarr A: Histological assessment of human periodontal defects after durapatite ceramic implant. J Periodontol 1983;51:455-464.
- Nabers CL, Reed OM, Hammer JE: Gross and histologic evaluation of an autogenous bone graft 57 months post-operatively. J Periodontol 1972;43:702-704.
- Nevins ML, Camelo M, Nevins M, King CJ, Oringer Rj, Schenk RK, Fiorellini JP: Human histologic evaluation of bioactive ceramic in the treatment of peridontal defects. Int J Periodont Rest Dent 2000;20:458-467.
- Nevins ML, Camelo M, Lynch SE, Schenk RK, Nevins M: Evaluation of periodontal regeneration following grafting intrabony detects with Bio-Oss Collagen: a human histologic report. Int J Periodontics Restorative Dent 2003;23:9-17.
- Ong MM, Eber RM, Korsnes Ml, MacNeil RL, Glickman GR, Shyr Y, Wang HL: Evaluation of bioactive glass alloplast in treating periodontal intrabony defects, J Periodontol 1998;69:1346-1354.
- Oreamuno S$, Lekovic V, Kenney EB, Carranza F Aj Takei HH, Prokic B: Comparative clinical study of porous hydroxyapatite and decalcified freeze-dried bone in human periodontal defects. J Periodontol 1990;61:399-404.
- Patur B: Osseous defects. Evaluation, diagnostic and treatment methods. J Periodontol 1974;45:523-541.
- Pearson GE, Rosen S, Deporter DA: Preliminary observations on the usefulness of decalcified freeze-dried cancellous bone allograft material in periodontal surgery. J Periodontol 1981;52:55-59.
- Plotzke AE, Barbosa S, Nasjleti CE, Morrison EC, Caffesse RG: Histologic and histometric responses to polymeric composite grafts. J Periodontol 1993;64:343-348.
- Renvert S, Garett S, Schallhorn RG, Egelberg J: Healing after treatment of periodontal intraosseous defects. III. Effect of osseous grafting and citric acid conditioning. J Clin Periodontol 1985;12:441-455.
- Richardson CR, Mellonig JT, Brunsvold MA, McDonnell HT, Cochran DL: Clinical evaluation of Bio-Oss: a bovine-derived xenograft for the treatment of periodontal osseous defects in humans. J Clin Periodontol 1999;26:421-428.
- Rivault AF, Toto PD, Levy S, Gargiulo AW: Autogenous bone grafts: osseous coagulum and osseous retrograde procedures in primates. J Periodontol 1971;42:787-788.
- Ross $, Cohen W: The fate of an osseous tissue autograft. A dinical and histologic case report. Periodontics 1968; 6: 145-151.
- Rummelhart JM, Mellonig JT, Gray JL, Towle Hy: A comparison of freeze-dried bone allograft and demineralized freeze-dried bone allograft in human periodontal osseous defects. J Periodontol 1989; 60: 655-663.
- Riihling A, Plagmann HC: Hydroxylapatit und Bioglas in parodontaien Knochentaschen - Klinisch-rontgenologische versus histologische Befunde. Parodontologie 2001;13:261-271.
- Saffar JL, Colombier ML, Detienville R: Bone formation in tri-calcium phosphate-filled periodontal intrabony lesions, Histologic observations in humans. J Periodontol 1990;61:209-216.
- Sapkos SW: The use of periograft in periodontal defects. Histologic findings. J Periodontol 1986;57:7-13.
- Schallhorn RG: The use of autogenous hip marrow biopsy implants for bony crater defects. J Periodontol 1968;39:145-147.
- Schwartz Z, Mellonig JT, Carnes DL jr, de la Fontaine J Cochran DL, Dean DD, Boyan BD: Ability of commercial demineralized freeze-dried bone allograft to induce new bone formation. J Periodontol 1996; 67: 918-926.
- Sculean A, Windisch P, Keglevich T, Chiantella GC, Gera I, Donos N: Clinical and histologic evaluation of human intrabony defects treated with an enamel matrix protein derivative combined with a bovine-derived xenograft. Int J Periodonf Rest Dent 2003;23:47-55.
- Sculean A, Windisch P, Keglevich T, Gera I: Clinical and histological evaluation of an enamel matrix protein derivative combined with a bioactive glass for the treatment of intrabony periodontal defects in humans. Int J Periodont Rest Dent 2004 (in press).
- Shahmiri S, Singh IJ, Stahl SS: Clinical response to the use of the HTR polymer implant in human intra-bony lesions. Int J Periodont Rest Dent 1992;12:294-299.
- Shigeyema Y, D’Errico JA, Stone R, Sommerman MJ: Commercially-prepared allograft material has biological activity in vitro. J Periodontol 1995;66:478-487.
- Snyder AJ, Levin MP, Cutright DE: Alloplastic implants of tri-calcium phosphate ceramic in human periodontal osseous defects. J Periodontol 1984;55:273-277.
- Sonis ST, Williams RC, Jeffcoat MK, Black R, Shklar G: Healing of spontaneous periodontal defects in dogs treated with xenogeneic demineralized bone. J Periodontol 1985;56:470-479.
- Stahl S, Froum S, Kushner L: Healing responses of human teeth following the use of debridemenf grafting and citric acid root conditioning. II. Clinical and histologic observations: One year post-surgery. J Periodontol 1983;54:325-338.
- Stahl S, Froum S: Histologic evaluation of human intraosseous healing responses to the placement of tricalcium phosphate ceramic implants. I. Three to eight months. J Periodontol 1986;57:211-217.
- Stahl SS, Froum S: Histologic and clinical responses to porous hydroxylapatite implants in human periodontal defects. Three to twelve months postimplantation. J Periodontol 1987;58:689-695.
- Stahl S, Froum S, Tarnow D: Human clinical and histologic responses to the placement of HTR polymer particles in 11 intrabony lesion. J Periodontol 1990; 61:269-274.
- Strub JR, Gaberthuel TW, Firestone AR: Comparison of tricalcium phosphate and frozen allogenic bone implants in man. J Periodontol 1979;50:624-629.
- Trombelli L, Heitz-Mayfield LJA, Needleman I, Moles D, Scabbia A: A systematic review of graft materials and biological agents for periodonfal intraosseous defects. J Clin Periodontol 2002;29:117-135.
- Urist MR, Strates B: Bone formation in implants of partially and wholly demineralized bone matrix. J Clin Orthop 1970;71:271-278.
- West TL, Brustein DD: Freeze-dried bone and coralline implants compared in the dog. J Periodontol 1985;56:348-351.
- Wikesjé UME, Selvig KA: Periodontal wound healing and regeneration. Periodontology 2000 1999; 19: 21-39.
- Wilson J, Low SB: Bioactive ceramics for periodontal treatment: comparative studies in the Patus monkey. J Appl Biomat 1992;3:123-129.
- World Workshop in Periodontology: The American Academy of Periodontology. Ann Periodontol 1996;1:618-670.
- Yukna R, Harrison BG, Caudill RE Evans GH, Mayer ET, Miller S: Evaluation of durapatite as an alloplastic implant in periodontal osseous defects. II. Twelve mounth reentry. J Periodontol 1985;56:540-547.
- Yukna R, Cassingham RJ, Caudill RE, Evans GF, Miller S, Mayer ET, Simon JF: Six months evaluation of Calcitite (hydroxyapatite ceramics) in periodontal osseous defects. Int J Periodont Rest Dent 1986;6:34-45.
- Yukna R: HTR polymer grafts in human periodontal osseous defects. I. 6-month clinical results. J Periodontol 1990;61:633-642.
- Yukna R: Clinical evaluation of coralline calcium carbopnate as a bone replacement graft material in human perjodontal osseous defects. J Periodontol 1994; 65: 177-185.
- ukna R, Yukna CN: A 5-year follow-up of 16 patients treated with coralline calcium carbonate (BIOCORAL) bone replacement grafts in infrabony defects. J Chin Periodontol 1998;25:1036-1040.
- Zamet JS, Darbar UR, Griffiths GS, Bulman JS, Bragger U, Burgin W, Newman HN: Parriculate bioglass as a grafting material in the treatment of periodontai intrabony implant in periodontal osseous defects. II. Twelve month defects. J Clin Periodontol 1997;24:410-418.
© Издательство «Индекс Медиа», 2004–2025. Все права защищены. Любое использование материалов или их фрагментов допускается только с письменного разрешения ООО «Индекс Медиа».